题目内容
18.将56g铁粉和16g硫粉隔绝空气加热,使其充分反应并冷却后,再加入适量盐酸,最后可得气体体积为(标准状况)( )| A. | 5.6L | B. | 11.2L | C. | 22.4L | D. | 44.8L |
分析 加热发生反应Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,由方程式可知加热过程中Fe无论过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,再根据V=nVm计算生成气体的体积.
解答 解:加热发生反应Fe+S $\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,
由方程式可知加热过程中Fe无论过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,
所以生成气体物质的量为:n(气体)=n(Fe)=$\frac{56g}{56g/mol}$=1mol,气体体积为1mol×22.4L/mol=22.4L,
故选C.
点评 本题考查化学方程式的计算,明确发生反应的实质为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
8.如图装置放置一段时间后,铁钉均被腐蚀.下列有关描述错误的是( )
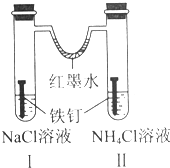

| A. | 红墨水水柱两边的液面变为左低右高 | |
| B. | Ⅰ和Ⅱ中负极反应式均为Fe-2e-=Fe2+ | |
| C. | Ⅰ中正极反应式为O2+2H2O+4e-=4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,生成蓝色沉淀 |
9.下列离子方程式书写正确的是( )
| A. | 氢氧化钡溶液滴入硫酸中:Ba2++SO42-→BaSO4↓ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+→Cu2++Ag | |
| C. | 醋酸加入氢氧化钠溶液中:H++OH-→H2O | |
| D. | 氯化铁溶液中滴入氢氧化钾溶液:Fe3++3OH-→Fe(OH)3↓ |
13.下列离子方程式书写正确的是( )
| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 氯化铁溶液中通入硫化氢气体:2Fe3++S2-═2Fe2++S↓ | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
3.下列说法中,不正确的是( )
| A. | 铝是地壳中含量最多的元素 | B. | 铁是人类冶炼最多的金属 | ||
| C. | 汞是所有金属中熔点最低的 | D. | 钙是人体内最多的金属元素 |
7. 在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.
在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.
(1)直接测定H2的体积和质量,操作上比较繁复,我们通常采用转化的思想,即把H2的质量转化成镁带的质量,所以实验中硫酸用过量;把H2的体积转化成所排液体的体积.
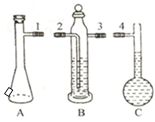
(2)如图中的A、B、C三部分能组成气体摩尔体积测定装置.
A、B、C装置接口的连接顺序是1324.
该装置正确连接后怎样做气密性检查?塞上A(气体发生器)加料口的橡皮塞,B(储液瓶)中导管液面会有所上升,上升的液柱1分钟内不下降,可以确认气密性良好.
本实验中有两次针筒抽气,需要记录的是第2次抽出气体的体积.
(3)这是某同学实验数据的记录:
温度:25℃,气压:101.3kPa
计算两次实验1mol氢气的体积的平均值=28.1L(保留一位小数).
实验温度下,1mol氢气的体积的理论值为24.5L,实验误差=14.7%(保留一位小数).
 在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.
在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.(1)直接测定H2的体积和质量,操作上比较繁复,我们通常采用转化的思想,即把H2的质量转化成镁带的质量,所以实验中硫酸用过量;把H2的体积转化成所排液体的体积.
(2)如图中的A、B、C三部分能组成气体摩尔体积测定装置.
A、B、C装置接口的连接顺序是1324.
该装置正确连接后怎样做气密性检查?塞上A(气体发生器)加料口的橡皮塞,B(储液瓶)中导管液面会有所上升,上升的液柱1分钟内不下降,可以确认气密性良好.
本实验中有两次针筒抽气,需要记录的是第2次抽出气体的体积.
(3)这是某同学实验数据的记录:
温度:25℃,气压:101.3kPa
| 实验次数 | 镁带质量(g) | 硫酸体积(mL) | C瓶读数(mL) | 抽出气体的体积(mL) |
| 1 | 0.108 | 10.0 | 129.2 | 8.0 |
| 2 | 0.105 | 10.0 | 125.7 | 6.2 |
实验温度下,1mol氢气的体积的理论值为24.5L,实验误差=14.7%(保留一位小数).
8.下列各组物质的分类都正确的是(括号里的是类别)( )
| A. | 空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质) | |
| B. | HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃) | |
| C. | 液氨(氢化物)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(强电解质) | |
| D. | NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯) |
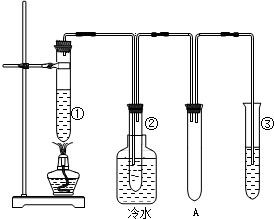 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.