题目内容
7. 在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.
在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.(1)直接测定H2的体积和质量,操作上比较繁复,我们通常采用转化的思想,即把H2的质量转化成镁带的质量,所以实验中硫酸用过量;把H2的体积转化成所排液体的体积.
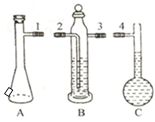
(2)如图中的A、B、C三部分能组成气体摩尔体积测定装置.
A、B、C装置接口的连接顺序是1324.
该装置正确连接后怎样做气密性检查?塞上A(气体发生器)加料口的橡皮塞,B(储液瓶)中导管液面会有所上升,上升的液柱1分钟内不下降,可以确认气密性良好.
本实验中有两次针筒抽气,需要记录的是第2次抽出气体的体积.
(3)这是某同学实验数据的记录:
温度:25℃,气压:101.3kPa
| 实验次数 | 镁带质量(g) | 硫酸体积(mL) | C瓶读数(mL) | 抽出气体的体积(mL) |
| 1 | 0.108 | 10.0 | 129.2 | 8.0 |
| 2 | 0.105 | 10.0 | 125.7 | 6.2 |
实验温度下,1mol氢气的体积的理论值为24.5L,实验误差=14.7%(保留一位小数).
分析 (1)依据Mg+2H+=Mg2++H2↑,测固体、液体质量和体积要比测气体质量和体积简单,据此解答;
(2)依据ABC三仪器作用及实验目的解答;装置气密性可以利用装置内气体压强变化和液面变化分析判断装置气密性;
每次做实验时,用注射器在A瓶加料口抽气,使B瓶导管内液体持平(B瓶内气体压强与外界大气压相等),注意注射器拔出时要将针头拔出,此时进入测定起始状态;再次抽气调压,用注射器在A瓶加料口处抽气,使B瓶中液面持平,与起始状态相同,读出注射器中抽出气体的体积,记录数值;
(3)依据实验步骤分析,加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积;依据实验的数据计算两次体积平均值;依据实验误差计算公式和计算得到的数据计算.
解答 解:(1)依据Mg+2H+=Mg2++H2↑,测固体、液体质量和体积要比测气体质量和体积简单,所以直接测定H2的体积和质量,操作上比较繁复,我们通常采用转化的思想,即把H2的质量转化成镁带的质量,所以实验中硫酸用过量;用排液法测定氢气体积,把H2的体积转化成所排液体的体积;
故答案为:镁带;所排液体;
(2)A为气体发生器用来制备氢气,B为储液瓶,用来盛放所排液体,C为液体量瓶,用来量取液体体积,要通过排液法测量氢气体积,应先产生气体,然后通过储液瓶,再利用液体量瓶量取液体体积,所以正确的顺序为:1324;
当A瓶加料口塞上橡胶塞微热,储液瓶(B瓶)内导管中液面会上升,并且一分钟内不下降,证明装置气密性完好;
每次做实验时,用注射器在A瓶加料口抽气,使B瓶导管内液体持平(B瓶内气体压强与外界大气压相等),注意注射器拔出时要将针头拔出,此时进入测定起始状态;再次抽气调压,用注射器在A瓶加料口处抽气,使B瓶中液面持平,与起始状态相同,读出注射器中抽出气体的体积,记录数值,
故答案为:1324;塞上A(气体发生器)加料口的橡皮塞,B(储液瓶)中导管液面会有所上升,上升的液柱1分钟内不下降,可以确认气密性良好;2;
(3)1中气体体积=129.2mL-10mL+8mL=127.2mL;
2中气体体积=125.7mL-10mL+6.2mL=121.9mL;
实验1测定体积为117.3mL,计算得到1mol氢气的体积=$\frac{0.1272×24}{0.108}$×1mol=28.26L;
实验2测定氢气的体积=111.9mL,计算得到1mol氢气的体积=$\frac{0.1219×24}{0.105}$×1mol=27.86L;两次测定的平均值=$\frac{28.26+27.86}{2}$=28.1L;
实验误差=$\frac{实验值-理论值}{理论值}$×100%=$\frac{28.1-24.5}{24.5}$×100%=14.7%;
故答案为:28.1;14.7%.
点评 本题考查了实验设计测定物质氢气体积的方法和步骤,数值换算和数据应用,误差分析判断的依据,注意图标数据的计算应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 参加反应的Zn质量一定相等 | B. | 硫酸反应完全,CH3COOH有剩余 | ||
| C. | 两种酸都有剩余 | D. | 参加反应的Zn的质量比为3:4 |
| A. | 5.6L | B. | 11.2L | C. | 22.4L | D. | 44.8L |
| A. | Na2CO3和HCl | B. | NaHSO4和Ba(OH)2 | C. | NaAlO2和H2SO4 | D. | AlCl3和NH3•H2O |
| A. | 固态 | B. | 液态 | ||
| C. | 气态 | D. | 三种状态都有可能 |
| A. | 沸点:乙烷>戊烷>2-甲基丁烷 | B. | 同分异构体种类:戊烷<戊烯 | ||
| C. | 密度:苯<水<硝基苯 | D. | 共线碳原子数:1,3-丁二烯>丙炔 |
①雾霾天气 ②用明矾净水 ③糖尿病人的血液透析④工厂利用静电除尘装置除尘.
| A. | 只有①② | B. | 只有①②④ | C. | 只有①②③ | D. | ①②③④ |