题目内容
燃料电池是一种新型电池,它主要是利用燃料在燃烧过程中把化学能直接转化为电能.氢氧燃料电池的基本反应如下,X极:2O2(g)+2H2O(l)+4e-=4OH-;Y极:2H2(g)+4OH--4e-=4H2O (l).下列判断正确的是( )
| A、X是正极 |
| B、Y是正极 |
| C、Y极发生还原反应 |
| D、X极发生氧化反应 |
考点:常见化学电源的种类及其工作原理
专题:电化学专题
分析:原电池中,失电子的极负极发生氧化反应,得电子的极正极发生还原反应,注意从化合价变化的角度判断.
解答:
解:X极:O2(g)+2H2O(l)+4e-=4OH-,该反应中O2得电子被还原,发生还原反应,应为原电池的正极反应,
Y极:2H2(g)+4OH--4e-=4H2O(l),该反应中H2失电子被氧化,发生氧化反应,应为原电池的负极反应.
故选A.
Y极:2H2(g)+4OH--4e-=4H2O(l),该反应中H2失电子被氧化,发生氧化反应,应为原电池的负极反应.
故选A.
点评:本题考查电极反应的判断,题目难度不大,解答本题可从化合价的变化的角度入手,把握电极反应.

练习册系列答案
相关题目
向FeI2和FeBr2物质的量之比为1:1的混合溶液中逐滴滴入氯水,下列离子反应不可能发生的是( )
| A、2Fe2++4I-+3Cl2→2Fe3++2I2+6Cl- |
| B、2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- |
| C、2Fe2++2I-+2Br-+3Cl2→2Fe3++I2+Br2+6Cl- |
| D、2Fe2++4I-+4Br-+5Cl2→2Fe3++2I2+2Br2+10Cl- |
下列过程中,不涉及化学变化的是( )
| A、浓硫酸加入蔗糖固体中 |
| B、氨气溶于水,水溶液呈碱性 |
| C、SO2使品红溶液褪色 |
| D、四氯化碳萃取碘水中的碘 |
将含amol Na2SO3的溶液与含bmol Na2S的溶液混合后,无明显现象;若加稀硫酸,则立即出现浅黄色沉淀,并有能使品红褪色的气体产生,则a与b的比值为( )
| A、大于2 | ||
| B、小于2 | ||
| C、等于2 | ||
D、大于
|
如图是产生和收集气体的实验装置,该装置不适合于( )
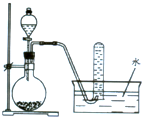

| A、用锌和盐酸制取H2 |
| B、用NH4Cl和Ca(OH)2制取NH3 |
| C、用电石和饱和食盐水制取C2H2 |
| D、用H2O2在MnO2催化下制O2 |
下有三组混合物:①氯化钠和水;②硫酸钡和水;③煤油和水;④碘水的混合物.分离以上混合液的正确方法依次是( )
| A、分液、萃取、蒸馏、过滤 |
| B、蒸发、过滤、分液、萃取 |
| C、分液、蒸发、萃取、过滤 |
| D、蒸馏、萃取、分液、蒸发 |
 (1)电镀时,镀件与电源的
(1)电镀时,镀件与电源的
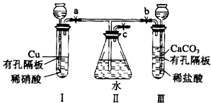 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.