题目内容
能证明Al2O3属离子化合物的是( )
| A、熔融时能导电 |
| B、可作耐火材料 |
| C、受热难分解 |
| D、能溶于NaOH溶液 |
考点:离子化合物的结构特征与性质
专题:化学键与晶体结构
分析:利用熔融状态下能否导电判断电解质,不能利用化学性质判断离子化合物,以此来解答.
解答:
解:A.熔融时能导电,可知由离子构成,可说明Al2O3属离子化合物,故A选;
B.熔点高的物质可作耐火材料,原子晶体中只有共价键也可作耐火材料,不能判断离子化合物,故B不选;
C.受热难分解也可能为共价化合物,如二氧化硅,不能判断离子化合物,故C不选;
D.能溶于NaOH溶液也可能为共价化合物,如HCl,不能判断离子化合物,故D不选;
故选A.
B.熔点高的物质可作耐火材料,原子晶体中只有共价键也可作耐火材料,不能判断离子化合物,故B不选;
C.受热难分解也可能为共价化合物,如二氧化硅,不能判断离子化合物,故C不选;
D.能溶于NaOH溶液也可能为共价化合物,如HCl,不能判断离子化合物,故D不选;
故选A.
点评:本题考查离子化合物的判断,为高频考点,把握离子化合物由离子构成为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
已知, ,某分子式为C11H16的含一个苯环的有机物,其被酸性高锰酸钾溶液氧化得到
,某分子式为C11H16的含一个苯环的有机物,其被酸性高锰酸钾溶液氧化得到 ,则该有机物可能的结构有( )
,则该有机物可能的结构有( )
 ,某分子式为C11H16的含一个苯环的有机物,其被酸性高锰酸钾溶液氧化得到
,某分子式为C11H16的含一个苯环的有机物,其被酸性高锰酸钾溶液氧化得到 ,则该有机物可能的结构有( )
,则该有机物可能的结构有( )| A、2种 | B、3种 | C、4种 | D、5种 |
下列变化过程中.所需克服的作用力均相同的是( )
| A、水气化 氯化钠熔化 |
| B、一冰升华 加热氯化按 |
| C、过氧化氢加入二氧化锰制氧气 碘化氢气体受热分解 |
| D、大理石高温生成二氧化碳.碘晶体升华为碘蒸气 |
消毒剂在日常生活、医疗、卫生、防疫中都有重要的作用,下列消毒剂的使用不正确的是( )
| A、过氧乙酸、漂白精是常用的消毒液 |
| B、食品加工、消毒防腐常使用福尔马林 |
| C、因患禽流感而被隔离的地区,常用生石灰处理 |
| D、医疗上常用75%的酒精进行消毒 |
下列关于烷烃的说法正确的是( )
| A、丙烷(C3H8)发生取代反应生成的C3H7Cl的结构只有一种 |
| B、丙烷分子中三个碳原子在一条直线上 |
| C、分子中含有六个碳原子的烷烃在常温下为液态物质 |
| D、烷烃的分子为直链式结构,不可以带支链 |
下列说法正确的是( )?
| A、碳原子间以单键相连的烃是烷烃? |
| B、所有糖类物质的组成符合Cn(H2O)m通式? |
| C、油与脂肪属于甘油酯? |
| D、葡萄糖与果糖互为同分异构体? |
下列数量的物质中,含原子数最多的是( )
| A、标准状况下11.2L CO2 |
| B、0.2mol NH3 |
| C、13.5g水 |
| D、6.02×1023个Ar原子 |
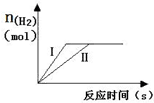 如图表示相同质量的Mg、Al分别跟一定量的稀H2SO4溶液反应的情况,下列叙述可能符合图示的是( )
如图表示相同质量的Mg、Al分别跟一定量的稀H2SO4溶液反应的情况,下列叙述可能符合图示的是( )| A、Mg、Al均不足,H2SO4过量 |
| B、消耗稀H2SO4的量是Ⅱ大于Ⅰ |
| C、Ⅰ表示Mg与稀H2SO4反应 |
| D、产生H2的速率是Ⅱ大于Ⅰ |