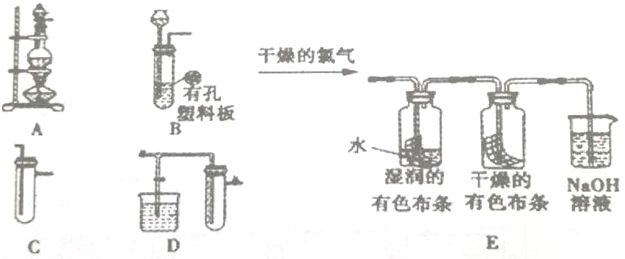
题目内容
12.下列化学用语表示正确的是( )| A. | 氯化钠的电子式为Na:$\underset{\stackrel{•}{C}}{•}\underset{\stackrel{•}{l}}{•}$: | |
| B. | 次氯酸的电子式H:$\underset{\stackrel{•}{C}}{•}\underset{\stackrel{•}{l}}{•}$: | |
| C. | 二氧化碳的结构式为O=C=O | |
| D. | NaHCO3的电离方程式为NaHCO3=Na++H++CO32- |
分析 A、氯化钠是离子化合物;
B、次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合;
C、二氧化碳为直线型结构,分子中存在两个碳氧双键;
D、碳酸氢钠只能完全电离为钠离子和碳酸氢根离子.
解答 解:A、氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ,故A错误;
,故A错误;
B、次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合,结构式为H-O-Cl,故电子式为: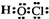 ,故B错误;
,故B错误;
C、二氧化碳为共价化合物,分子中存在两个碳氧双键,且为直线型结构,二氧化碳的结构式为:O=C=O,故C正确;
D、碳酸氢钠属于强电解质,完全电离,碳酸氢根离子是多元弱酸碳酸的酸式盐的酸根离子,不能完全电离,正确电离方程式为:NaHCO3═HCO3-+Na+,故D错误.
故选C.
点评 本题考查了常见的化学用语,难度不大,应注意的是碳酸氢钠和硫酸氢钠电离方程式的书写的区别.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
2. 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1.
已知:H2O(l)=H2O(g)△H=+44kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-305.7kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如表:
①该反应是吸热反应(填“吸热”或“放热”);
②T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
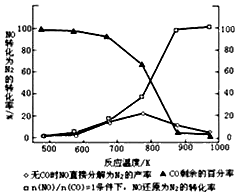
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图.
①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式CH4+2NO2=CO2+N2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池负极的电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O.
 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1.
已知:H2O(l)=H2O(g)△H=+44kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-305.7kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图.
①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式CH4+2NO2=CO2+N2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池负极的电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O.
3.含6.02×1024个中子的188O的质量是( )
| A. | 18g | B. | 16g | C. | 8g | D. | 10g |
20.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在含有NA个CH3COO-的醋酸溶液中,H+数目略大于NA | |
| B. | 1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA | |
| C. | 电解精炼铜时,若转移了NA个电子,则阳极质量减小32g | |
| D. | 标况下,11.2LSO3所含的分子数目为0.5NA |
7.常温下,下列各组微粒在指定溶液中可能大量共存的是( )
| A. | 0.1 mol/L FeCl3溶液:K+、Br-、H2O2 | |
| B. | 含大量NO3-的溶液:Fe2+、SO42-、H+ | |
| C. | 水电离产生的c(OH-)=10-13mol/L的溶液:Al3+、Na+、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:NH4+、CrO42-、ClO- |
19.向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g)?PCl3(g)+Cl2(g)△H=+124kJ•mol-1.反应过程中测定的部分数据见表:
回答下列问题:(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s)
(2)温度为T时,该反应的化学平衡常数=0.025
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%
要提高平衡时PCl3的体积分数,可采取的措施有CD
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
(2)温度为T时,该反应的化学平衡常数=0.025
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%
要提高平衡时PCl3的体积分数,可采取的措施有CD
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
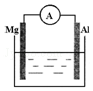 如图所示装置中,金属镁、铝和电流表通过导线相连:
如图所示装置中,金属镁、铝和电流表通过导线相连: