题目内容
3.一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3•CoO的形式存在,吸附在铝箔的单面或双面,锂混杂于其中,从废料中回收氧化钴(CoO)的工艺流程如图: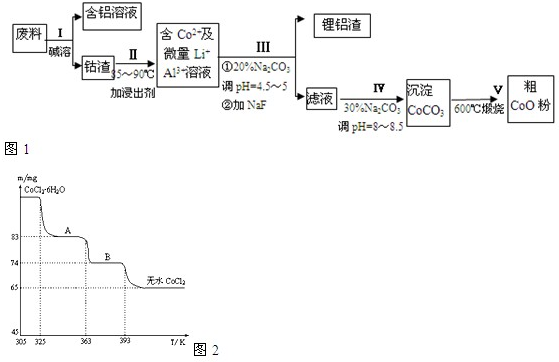
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为2Al+2OH-+2H2O=+2AlO2-+3H2↑.
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的化学反应方程式为(产物中只有一种酸根)4Co2O3•CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O.在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因Co2O3•CoO可氧化盐酸产生Cl2,污染环境.
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑.
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是调整pH,提供CO32-,使Co2+沉淀为CoCO3.
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是BD(填序号).
A、c(Na+)=2c(CO32-)
B、c(Na+)>c(CO32-)>c(HCO3-)
C、c(HCO3-)>c(OH-)>c(H+)
D、c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3)
(6)CoO溶于盐酸可得粉红色的CoCl2溶液.CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水.如图是粉红色的CoCl2•6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是CoCl2•2H2O.
分析 操作Ⅰ利用了铝能溶解在氢氧化钠溶液的性质,将铝从废料中分离出来,过滤后得到含Co2O3•CoO的钴渣,再用酸溶解过滤后得到含Co3+及Al3+、Li+的滤液,通过调整溶液的pH得到Al(OH)3和LiF沉淀,再过滤得到含Co3+的滤液,再滴加Na2CO3溶液得到CoCO3沉淀,经过滤、洗涤沉淀,最后将CoCO3进行加热分解可得CoO粉末,
(1)铝和氢氧化钠反应生成偏铝酸钠和氢气,注意该反应中水是反应物;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,盐酸具有还原性,能被Co2O3•CoO氧化生成有毒的氯气而污染环境;(3)根据铝离子水解显酸性,碳酸根离子水解显碱性,二者在同溶液里会发生双水解生成氢氧化铝和二氧化碳;
(4)碳酸钠溶液在过程Ⅳ中调整pH,提供CO32-,使Co2+沉淀为CoCO3;
(5)A.根据电荷书恒判断;
B.根据碳酸根离子发生水解以及水的电离判断出离子浓度的大小;
C.根据碳酸根离子发生水解以及水的电离判断出离子浓度的大小;
D.根据质子守恒判断;
(6)根据关系式CoCl2•6H2O~CoCl2求出CoCl2•6H2O的质量,然后再根据差量法求出A物质的化学式.
解答 解:(1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为:2Al+2OH-+2H2O=+2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=+2AlO2-+3H2↑;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,所以加入Na2S2O3的作用是还原Co3+,盐酸具有还原性,能被Co2O3•CoO氧化生成有毒的氯气而污染环境,所以不能盐酸,
故答案为:4Co2O3•CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;Co2O3•CoO可氧化盐酸产生Cl2,污染环境;
(3)铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(4)碳酸钠溶液在过程Ⅳ中调整pH,提供CO32-,使Co2+沉淀为CoCO3;
故答案为:调整pH,提供CO32-,使Co2+沉淀为CoCO3;
(5)A.Na2CO3溶液中电荷守恒:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故A错误;
B.碳酸根离子发生水解以及水的电离,所以溶液中离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故B正确;
C.碳酸根离子发生水解以及水的电离,所以溶液中离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故C错误;
D.Na2CO3溶液中质子守恒:c(H+)═c(OH-)+c(HCO3-)+2c(H2CO3),故D正确;
故选:BD;
(6)CoCl2•6H2O~CoCl2
238 130
m 65mg
$\frac{238}{m}$=$\frac{130}{65mg}$ 解得:m=119mg
A物质的化学式为CoCl2•nH2O,则有:
CoCl2•6H2O~CoCl2•nH2O△m
238 18(6-n)
119mg 119mg-83mg
$\frac{238}{119mg}$=$\frac{18(6-n)}{119mg-83mg}$,解得:n=2,
所以A物质的化学式为:CoCl2•2H2O;
故答案为:CoCl2•2H2O.
点评 本题考查了金属及其化合物的性质,考查氧化还原反应、离子反应、关系式计算等,难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查,是一道不错的能力考查题.

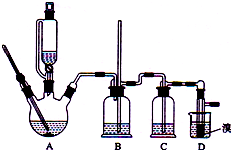 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在A装置的实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发.
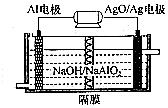 (1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.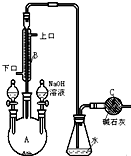 制备溴苯的实验装置如右图所示,请回答下列问题:
制备溴苯的实验装置如右图所示,请回答下列问题: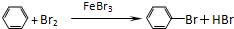 .
. +Br+→[
+Br+→[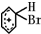 ];[
];[ ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3.由上述反应可推知:
+HBr+FeBr3.由上述反应可推知: +Br2→
+Br2→ +HBr 中的催化剂为BD.(填字母)
+HBr 中的催化剂为BD.(填字母)

