题目内容
甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等.工业上利用煤在高温下气化得到的水煤气合成甲醇、甲醚.请回答下列问题: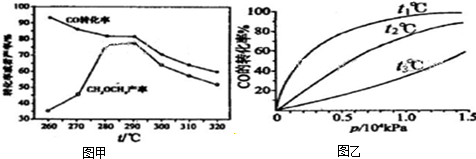
(1)写出煤的气化(生成水煤气)的主要化学反应方程式 .
(2)一定温度下,若反应CO(g)+H2O(g)?CO2(g)+H2(g)在一密闭容器中进行,能判定该反应达平衡状态的是 (填序号).
A.容器中气体的密度不变 B.v(CO)正=v(CO2)逆
C.混合气体中c(H2)=c(H2O) D.容器内的物质的量不变
(3)利用水煤气合成甲醚的三步反应为:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
则由H2和CO生成CH3OCH3和CO2的热化学方程式为: .
(4)CO和H2可用于合成甲醇(CH3OH),如图甲是CO在不同温度下的平衡转化率与压强的关系图,则温度t1、t2、t3三者的高低关系是 ,实际生产控制在t1℃、1.3×104kPa左右,选择此压强的理由是 .
(5)某温度下.2CH3OH(g)?CH3OCH3(g)+H2O(g)的平衡常数为400,此温度下,在2L密闭容器中加入3.28mol CH3OH,10分钟达平衡,则该时间内由甲醇生产甲醚的反应速率为v(CH3OCH3)= .若此时再分别加入1mol CH3OH 和2mol的H2O(g),则此时”v正 v逆(填“>”“=”“<”).
(6)有研究者在催化剂、5.0MPa条件下,由CO和H2直接制备甲醚,结果如图乙所示,CO的转化率随温度升高而降低的原因是 .

(1)写出煤的气化(生成水煤气)的主要化学反应方程式
(2)一定温度下,若反应CO(g)+H2O(g)?CO2(g)+H2(g)在一密闭容器中进行,能判定该反应达平衡状态的是
A.容器中气体的密度不变 B.v(CO)正=v(CO2)逆
C.混合气体中c(H2)=c(H2O) D.容器内的物质的量不变
(3)利用水煤气合成甲醚的三步反应为:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
则由H2和CO生成CH3OCH3和CO2的热化学方程式为:
(4)CO和H2可用于合成甲醇(CH3OH),如图甲是CO在不同温度下的平衡转化率与压强的关系图,则温度t1、t2、t3三者的高低关系是
(5)某温度下.2CH3OH(g)?CH3OCH3(g)+H2O(g)的平衡常数为400,此温度下,在2L密闭容器中加入3.28mol CH3OH,10分钟达平衡,则该时间内由甲醇生产甲醚的反应速率为v(CH3OCH3)=
(6)有研究者在催化剂、5.0MPa条件下,由CO和H2直接制备甲醚,结果如图乙所示,CO的转化率随温度升高而降低的原因是
考点:热化学方程式,化学平衡状态的判断,转化率随温度、压强的变化曲线
专题:化学反应中的能量变化,化学平衡专题
分析:(1)碳和水反应生成一氧化碳和氢气,根据质量守恒定律可以书写化学方程式;
(2)反应到达平衡状态时正逆反应速率相等,各物质的浓度保持不变,以及由此衍生的一些量保持不变,据此分析;
(3)根据已知方程式,利用盖斯定律计算;
(4)CO和 H2合成甲醇(CH3OH)的反应为放热反应,根据温度对CO转化率的影响分析;根据压强对转化率及生产成本的影响分析;
(5)列三段式,根据K求出CH3OCH3的浓度变化,再求出反应速率;根据
与平衡常数K的关系分析;
(6)依据温度对化学平衡移动的影响分析.
(2)反应到达平衡状态时正逆反应速率相等,各物质的浓度保持不变,以及由此衍生的一些量保持不变,据此分析;
(3)根据已知方程式,利用盖斯定律计算;
(4)CO和 H2合成甲醇(CH3OH)的反应为放热反应,根据温度对CO转化率的影响分析;根据压强对转化率及生产成本的影响分析;
(5)列三段式,根据K求出CH3OCH3的浓度变化,再求出反应速率;根据
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
(6)依据温度对化学平衡移动的影响分析.
解答:
解:(1)碳和水反应生成一氧化碳和氢气的化学方程式为:C+H2O
CO+H2,故答案为:C+H2O
CO+H2;
(2)A.容器的体积不变,气体的质量守恒,所以容器中气体的密度始终不变,因此不能根据密度不变来判断平衡状态,故A错误;
B.反应到达平衡状态时正逆反应速率相等,所以v(CO)正=v(CO2)逆,即是平衡状态,故B正确;
C.混合气体中c(H2)与c(H2O) 的关系,与初始量有关,所以不能说明达到平衡状态,故C错误;
D.该反应前后气体的总物质的量相等,所以容器内的物质的量不变,不能说明达到平衡状态,故D错误;
故答案为:B;
(3)已知:①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
由盖斯定律可知,通过①×2+②+③可得3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),则△H=-90.8kJ/mol×2-23.5kJ/mol-41.3kJ/mol=-246.4kJ/mol,
故答案为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ?mol-1;
(4)CO和 H2合成甲醇(CH3OH)的反应为放热反应,升高温度平衡逆移,则CO转化率减小,即温度越高CO的转化率越小,由图可知,温度的关系为:
t1<t2<t3;此压强下转化率已经很大,再增大压强转化率改变很小,而且增大压强会提高生产成本;
故答案为:t1<t2<t3;此压强下转化率已经很大,再增大压强转化率改变很小,而且增大压强会提高生产成本;
(5)在2L密闭容器中加入3.28mol CH3OH,则开始时甲醇的浓度为1.64mol/L,设转化的甲醇的浓度为xmol/L,
2CH3OH(g)≒CH3OCH3(g)+H2O(g)
起始浓度(mol?L-1):1.64 0 0
转化浓度(mol?L-1):x
x
x
平衡浓度(mol?L-1):1.64-x
x
x
已知此时平衡常数为400,则K=
=400,解得x=1.6;则c(CH3OCH3)=0.8mol?L-1,所以v(CH3OCH3)=
=0.08mol?L-1?min-1,
若此时再分别加入1mol CH3OH 和2mol的H2O(g),则c(CH3OH)=1.64mol?L-1-1.6mol?L-1+0.5mol?L-1=0.54mol?L-1,c(H2O)=0.8mol?L-1+1mol?L-1=1.8mol?L-1,c(CH3OCH3)=0.8mol?L-1,所以
=
=4.9<K=400,说明未达到平衡状态,所以反应正向进行,即v正>v逆
故答案为:0.08mol?L-1?min-1;>;
(6)因为该反应为放热反应,所以升高温度平衡逆向移动,则CO的转化率减小;
故答案为:反应放热,升高温度平衡逆移.
| ||
| ||
(2)A.容器的体积不变,气体的质量守恒,所以容器中气体的密度始终不变,因此不能根据密度不变来判断平衡状态,故A错误;
B.反应到达平衡状态时正逆反应速率相等,所以v(CO)正=v(CO2)逆,即是平衡状态,故B正确;
C.混合气体中c(H2)与c(H2O) 的关系,与初始量有关,所以不能说明达到平衡状态,故C错误;
D.该反应前后气体的总物质的量相等,所以容器内的物质的量不变,不能说明达到平衡状态,故D错误;
故答案为:B;
(3)已知:①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
由盖斯定律可知,通过①×2+②+③可得3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),则△H=-90.8kJ/mol×2-23.5kJ/mol-41.3kJ/mol=-246.4kJ/mol,
故答案为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ?mol-1;
(4)CO和 H2合成甲醇(CH3OH)的反应为放热反应,升高温度平衡逆移,则CO转化率减小,即温度越高CO的转化率越小,由图可知,温度的关系为:
t1<t2<t3;此压强下转化率已经很大,再增大压强转化率改变很小,而且增大压强会提高生产成本;
故答案为:t1<t2<t3;此压强下转化率已经很大,再增大压强转化率改变很小,而且增大压强会提高生产成本;
(5)在2L密闭容器中加入3.28mol CH3OH,则开始时甲醇的浓度为1.64mol/L,设转化的甲醇的浓度为xmol/L,
2CH3OH(g)≒CH3OCH3(g)+H2O(g)
起始浓度(mol?L-1):1.64 0 0
转化浓度(mol?L-1):x
| 1 |
| 2 |
| 1 |
| 2 |
平衡浓度(mol?L-1):1.64-x
| 1 |
| 2 |
| 1 |
| 2 |
已知此时平衡常数为400,则K=
| ||||
| (1.64-x)2 |
| 0.8mol/L |
| 10min |
若此时再分别加入1mol CH3OH 和2mol的H2O(g),则c(CH3OH)=1.64mol?L-1-1.6mol?L-1+0.5mol?L-1=0.54mol?L-1,c(H2O)=0.8mol?L-1+1mol?L-1=1.8mol?L-1,c(CH3OCH3)=0.8mol?L-1,所以
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| 1.8×0.8 |
| 0.542 |
故答案为:0.08mol?L-1?min-1;>;
(6)因为该反应为放热反应,所以升高温度平衡逆向移动,则CO的转化率减小;
故答案为:反应放热,升高温度平衡逆移.
点评:本题考查了方程式的书写、化学平衡状态的判断、盖斯定律的应用、平衡移动原理的应用、反应速率及平衡常数的计算等,题目考查的知识点较多,题目综合性强,注意对相关原理的把握,题目难度中等.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图: | ||
B、CO2的电子式: | ||
C、中子数为20的氯原子:
| ||
| D、明矾的化学式:KAlSO4?12H2O |
下列各组离子,能在强酸溶液中大量共存.并且溶液呈无色的是( )
| A、Mg2+、Na+、SO42-、Cl- |
| B、K+、Na+、NO3-、MnO4- |
| C、Na+、Ca2+、OH-、HCO3- |
| D、NH4+、Cu2+、NO3-、Cl- |
下列说法正确的是( )
| A、将AlCl3溶液加热蒸干可得AlCl3固体 |
| B、实验室配制氯化铁溶液时通常需要加入盐酸,目的是抑制铁离子水解 |
| C、将AlCl3溶液和Na2S溶液混合可得到Al2S3沉淀 |
| D、向氯化铵溶液中加入少量的硫酸铁固体,浓度会减少 |
在纯水中加入物质的量相等的Ag+、Pb2+、Na+、NO3-、SO42-、Cl-,再用惰性电极电解此溶液,并收集两极电解产物,则所得氧化产物与还原产物的质量比最接近于( )
| A、8:1 |
| B、108:35.5 |
| C、35.5:108 |
| D、16:207 |
 现有A、B、C、D四种溶液,在进行焰色反应时,火焰颜色都为黄色,它们之间转化关系如图所示.已知B为NaHCO3,请回答下列问题:
现有A、B、C、D四种溶液,在进行焰色反应时,火焰颜色都为黄色,它们之间转化关系如图所示.已知B为NaHCO3,请回答下列问题: