题目内容
14.某学习小组探究温度对Fe3+水解的影响.通过测量不同温度下溶液透光率(对光的透过能力)的变化判断平衡移动的方向.一般情况下溶液颜色越深,透光率越小.(1)Fe3+(aq)+3H2O(l)?Fe(OH)3(aq)+3H+(aq)△H>0
①加热,溶液颜色变深,平衡向右移动.
②通常在FeCl3溶液中加入少量HCl,目的是抑制铁离子水解.
(2)探究温度对Fe3+水解的影响.
【假设】当温度升高时,Fe3+水解平衡正向移动,溶液的颜色会变深,透光率减小;如果降温时反应可逆回,则溶液的颜色应该变浅,透光率增大.
【实验】分别加热0.5mol/LFe(NO3)3、FeCl3溶液(均未酸化)至50℃后停止加热,自然冷却.测得的温度变化曲线及透光率变化曲线如图所示.
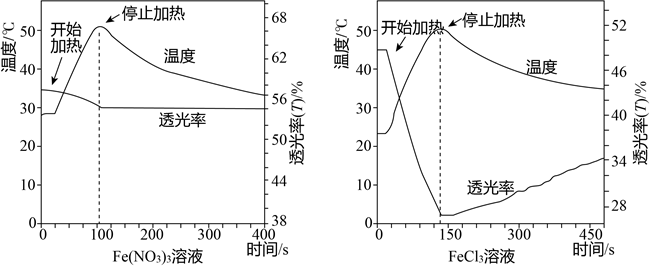
①Fe(NO3)3、FeCl3溶液浓度相同,目的是保证铁离子浓度相等.
②小组依据变化曲线推测:FeCl3溶液颜色随温度变化的改变可能不完全是由水解平衡引起的.推测的根据是0.5mol/LFe(NO3)3、FeCl3溶液(均未酸化),50℃后停止加热,自然冷却,两者透光率不同.
(3)为证实小组推测,实验如下:
| 编号 | 实验 | 操作及现象 |
| a | 向Fe(NO3)3溶液(棕黄色)中加入大量HNO3 | i.溶液颜色非常浅 ii.加热和降温过程中透光率无明显变化 |
| b | 向FeCl3溶液(黄色)中加入大量HNO3 | i.溶液仍为黄色 ii.加热透光率下降,降温透光率上升 |
②小组推测是否合理,说明理由合理,阴离子不同,溶液颜色不同.
(4)【查阅文献】Fe3++nCl-?[FeCln]3-n(黄色)△H>0(n=1~4).该平衡可以解释FeCl3溶液实验的现象,通过如下实验得到了证实.
【实验】(将实验过程补充完整):
| 编号 | 实验 | 操作及现象 |
| c | 向Fe(NO3)3溶液中加入大量HNO3,再加入几滴NaCl溶液. | 测此溶液透光率随温度改变的变化情况,增加氯离子浓度,有色离子浓度增加 |
分析 (1)根据平衡移动原理分析,改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;
(2)①对照实验需满足只有一个条件不同,进行比较;
②从图示可知,0.5mol/LFe(NO3)3、FeCl3溶液(均未酸化),50℃后停止加热,自然冷却,两者透光率不同,FeCl3溶液透光率随温度升高而减小的幅度明显大于Fe(NO3)3溶液;
(3)①氯化铁中存在的[FeCl4(H2O)2]-为黄色,实验a、b加入大量HNO3的作用是抑制水解,验证阴离子不同对铁离子水解的影响;
②对照实验a、b,小组推测合理;
(4)验证氯离子的影响需加入氯离子,测此溶液透光率随温度改变的变化情况,增加氯离子浓度,有色离子浓度增加.
解答 解:(1)①Fe3+(aq)+3H2O(l)?Fe(OH)3(aq)+3H+(aq)△H>0正反应为吸热反应,升高温度平衡向吸热方向移动,所以平衡向右移动,溶液颜色变深,
故答案为:右;
②通常在FeCl3溶液中加入少量HCl,氯化氢在溶液中为强酸,电离出氢离子,增大生成物浓度,平衡逆向移动,抑制铁离子水解,
故答案为:抑制铁离子水解;
(2)①分别加热0.5mol/LFe(NO3)3、FeCl3溶液(均未酸化)至50℃后停止加热,自然冷却,铁离子浓度相等,阴离子不同,比较阴离子不同对Fe3+水解是否有影响,
故答案为:铁离子浓度;
②从图示可知,0.5mol/LFe(NO3)3、FeCl3溶液(均未酸化),50℃后停止加热,自然冷却,0.5mol/LFe(NO3)3透光率强于0.5mol/LFeCl3溶液(均未酸化),由此可推测:FeCl3溶液颜色随温度变化的改变可能不完全是由水解平衡引起的,
故答案为:0.5mol/LFe(NO3)3、FeCl3溶液(均未酸化),50℃后停止加热,自然冷却,两者透光率不同;
(3)①实验a、b对比,硝酸铁溶液加入硝酸溶液,溶液中氢离子浓度增大,
硝酸铁中存在:[Fe(H2O)6]3++H2O?[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+,Fe(NO3)3溶液呈黄色的原因是[Fe(H2O)6]3+水解产生了黄色的[Fe(H2O)6-n(OH)n]3-n,
FeCl3溶液呈黄色主要是发生:[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O,由于含有[FeCl4(H2O)2]-的缘故,试管a、b中加入大量的HNO3后,溶液中氢离子浓度增大,抑制水解,a中溶液褪色,而b中溶液仍呈黄色,为验证阴离子不同对铁离子水解的影响,
故答案为:为验证阴离子不同对铁离子水解的影响;
②对照实验a、b,合理,阴离子不同,溶液颜色不同,
故答案为:合理,阴离子不同,溶液颜色不同;
(4)Fe3++nCl-?[FeCln]3-n(黄色)△H>0(n=1~4).增加氯离子浓度,平衡[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O中,可以引起化学平衡正向移动,有色离子浓度增加,进而说明FeCl3溶液透光率随温度升高而减小的幅度明显大于Fe(NO3)3溶液,溶液颜色与阴离子有关,
故答案为:几滴NaCl溶液;测此溶液透光率随温度改变的变化情况,增加氯离子浓度,有色离子浓度增加.
点评 本题考查了对探究实验方案分析评价、信息获取与迁移运用,注意充分利用对照实验进行分析,是对现实综合能力的考查,难度中等.

| A. | 两溶液中水的电离程度相同 | |
| B. | 盐酸溶液中c(Cl-)等于NaOH溶液中c (Na+) | |
| C. | 若两溶液等体积混合能恰好中和 | |
| D. | 分别稀释10倍后,两溶液的pH之和大于14 |

回答下列问题:
(1)电池负极反应式是BH4-+8OH--8e-=BO2-+6H2O,电解池阳极生成N2O5的电极反应式是N2O4+2HNO3-2e-=2N2O5+2H+.
(2)隔膜不允许水分子通过的原因是H2O 通过隔膜进入阳极,与N2O5反应生成HNO3.N2O5在一定温度下可发生分解反应:2N2O5 (g)?2N2O4(g)+O2(g)△H>0,t℃时,向一定容积的密闭容器中通入N2O5(g),部分实验数据见下表:
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 2.25 | 2.50 | 2.50 |
(4)t℃时,该反应平衡常数K值为1.25.
(5)下列措施能降低N2O5分解率的是③④⑤.
①升温 ②通入N2 ③通入O2 ④通入N2O5 ⑤NO2.
| A. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| B. | 实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH- | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;△\;}}{\;}$NH3↑+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++H2O2═2Mn2++3O2↑+4H2O |
| A. | 原子半径:S<Cl | |
| B. | 元素非金属性:S>Cl | |
| C. | 氢化物的稳定性:H2S>HCl | |
| D. | 最高价氧化物对应水化物的酸性:H2SO4<HClO4 |
| A. | 向Al(OH)3沉淀滴加NaOH或盐酸沉淀均消失,说明Al(OH)3是两性氢氧化物 | |
| B. | 饱和Na2S溶液中滴入少量氯水出现浑浊,说明元素非金属性Cl>S | |
| C. | 将铜丝插入锌粒与稀硫酸反应体系中反应明显加快,原因是形成了原电池 | |
| D. | 饱和食盐水中滴入浓硫酸析出食盐晶体,说明浓硫酸吸水放出大量的热 |

 E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大.E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态.请回答下列问题:
E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大.E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态.请回答下列问题: