题目内容
9.燃烧法是测定有机化合物分子式的一种重要方法.将0.2mol有机化合物A与标准状况下17.92L氧气混合点燃,两者刚好反应,只得到三种产物:CO、CO2和H2O.将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重14.4克,碱石灰增重17.6克.剩余气体通过足量灼热氧化铜,测得固体质量减少6.4g,试分析:
(1)有机化合物A的分子式(要求写出推理过程)
(1)若有机化合物A能与碳酸氢钠溶液反成产生气体,请写出A所有可能的结构简式.
分析 n(O2)=$\frac{17.92L}{22.4/mol}$=0.8mol,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重14.4克,为水的质量,则n(H2O)=$\frac{14.4g}{18g/mol}$=0.8mol,可知n(H)=1.6mol,碱石灰增重1.76克,为二氧化碳的质量,则n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,剩余气体通过足量灼热氧化铜,测得固体质量减少6.4g,发生CO+CuO$\frac{\underline{\;加热\;}}{\;}$Cu+CO2,由方程式可知固体质量减少的量为氧原子的质量,等于CO的物质的量,则n(CO)=$\frac{6.4g}{16g/mol}$=0.4mol,结合氧原子守恒可确定有机物分子式,结合性质可确定有机物的结构简式.
解答 解:(1)n(O2)=$\frac{17.92L}{22.4/mol}$=0.8mol,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重14.4克,为水的质量,则n(H2O)=$\frac{14.4g}{18g/mol}$=0.8mol,可知n(H)=1.6mol,碱石灰增重1.76克,为二氧化碳的质量,则n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,剩余气体通过足量灼热氧化铜,测得固体质量减少6.4g,发生CO+CuO$\frac{\underline{\;加热\;}}{\;}$Cu+CO2,由方程式可知固体质量减少的量为氧原子的质量,等于CO的物质的量,则n(CO)=$\frac{6.4g}{16g/mol}$=0.4mol,
由氧原子守恒可知0.2mol有机物中n(O)=0.4mol×2+0.4mol+0.8mol-2×0.8mol=0.4mol,
则有机物中N(C)=$\frac{0.4mol+0.4mol}{0.2mol}$=4,N(H)=$\frac{0.8mol×2}{0.2mol}$=8,N(O)=$\frac{0.4mol}{0.2mol}$=2,所以分子式为C4H8O2,
答:有机化合物A的分子式C4H8O2;
(2)若有机化合物A能与碳酸氢钠溶液反成产生气体,则含有羧基,应为C3H7COOH,对应的有机物可能为CH3CH2CH2COOH或CH3CH(CH3)COOH.
答:A所有可能的结构简式为CH3CH2CH2COOH或CH3CH(CH3)COOH.
点评 本题考查有机物的推断,侧重于学生计算能力和分析能力的考查,题目难度中等,注意把握有机物的燃烧规律,结合有机物的性质进行推断.

| A. | 质量数是1 | B. | 质子数是2 | C. | 中子数是2 | D. | 电子数是1 |
| A. | 3L | B. | 2L | C. | 1L | D. | 无法确定 |
(1)Fe3+(aq)+3H2O(l)?Fe(OH)3(aq)+3H+(aq)△H>0
①加热,溶液颜色变深,平衡向右移动.
②通常在FeCl3溶液中加入少量HCl,目的是抑制铁离子水解.
(2)探究温度对Fe3+水解的影响.
【假设】当温度升高时,Fe3+水解平衡正向移动,溶液的颜色会变深,透光率减小;如果降温时反应可逆回,则溶液的颜色应该变浅,透光率增大.
【实验】分别加热0.5mol/LFe(NO3)3、FeCl3溶液(均未酸化)至50℃后停止加热,自然冷却.测得的温度变化曲线及透光率变化曲线如图所示.
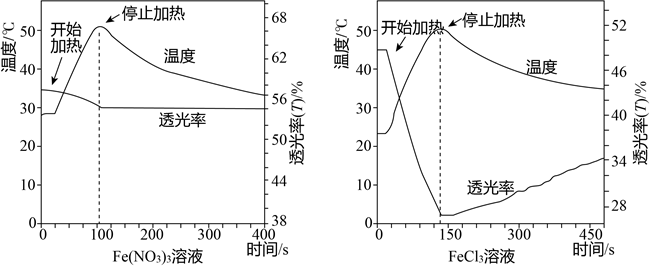
①Fe(NO3)3、FeCl3溶液浓度相同,目的是保证铁离子浓度相等.
②小组依据变化曲线推测:FeCl3溶液颜色随温度变化的改变可能不完全是由水解平衡引起的.推测的根据是0.5mol/LFe(NO3)3、FeCl3溶液(均未酸化),50℃后停止加热,自然冷却,两者透光率不同.
(3)为证实小组推测,实验如下:
| 编号 | 实验 | 操作及现象 |
| a | 向Fe(NO3)3溶液(棕黄色)中加入大量HNO3 | i.溶液颜色非常浅 ii.加热和降温过程中透光率无明显变化 |
| b | 向FeCl3溶液(黄色)中加入大量HNO3 | i.溶液仍为黄色 ii.加热透光率下降,降温透光率上升 |
②小组推测是否合理,说明理由合理,阴离子不同,溶液颜色不同.
(4)【查阅文献】Fe3++nCl-?[FeCln]3-n(黄色)△H>0(n=1~4).该平衡可以解释FeCl3溶液实验的现象,通过如下实验得到了证实.
【实验】(将实验过程补充完整):
| 编号 | 实验 | 操作及现象 |
| c | 向Fe(NO3)3溶液中加入大量HNO3,再加入几滴NaCl溶液. | 测此溶液透光率随温度改变的变化情况,增加氯离子浓度,有色离子浓度增加 |
