题目内容
13.向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,生成沉淀.已知AgCl(s)的溶度积常数Ksp=c(Ag+)×c(Cl-)=1×10-10.(混合后溶液的体积变化忽略不计).试计算(1)沉淀生成后溶液中Ag+的浓度
(2)沉淀生成后溶液的pH.
分析 混合后,c(Ag+)=$\frac{0.05L×0.018mol/L}{0.1L}$=0.009mol/L,c(Cl-)=$\frac{0.05L×0.02mol/L}{0.1L}$=0.01mol/L,由Ag++Cl-=AgCl↓可知,氯离子过量,结合Ksp计算c(Ag+),c(H+)=c(Cl-)=0.01mol/L,以此计算.
解答 解:混合后,c(Ag+)=$\frac{0.05L×0.018mol/L}{0.1L}$=0.009mol/L,c(Cl-)=$\frac{0.05L×0.02mol/L}{0.1L}$=0.01mol/L,由Ag++Cl-=AgCl↓可知,氯离子过量0.001mol/L,
(1)沉淀生成后溶液中Ag+的浓度为c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$=$\frac{1×1{0}^{-10}}{0.001}$=1×10-7mol/L,
答:沉淀生成后溶液中Ag+的浓度为1×10-7mol/L;
(2)沉淀生成后氢离子的物质的量不变,c(H+)=c(Cl-)=0.01mol/L,则pH=-lg(10-2)=2,
答:沉淀生成后溶液的pH为2.
点评 本题考查难溶电解质的计算,为高频考点,把握氯离子过量、Ksp计算、pH计算等为解答的关键,侧重分析与计算能力的考查,注意发生的反应及氢离子物质的量不变,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
6.将过量的CO2分别通入①CaCl2溶液;②Na2SiO3溶液;③NaAlO2溶液;④饱和Na2CO3溶液;⑤Ca(OH)2溶液⑥Ca(ClO)2溶液.最终溶液中有沉淀或晶体析出的是( )
| A. | ①②③④ | B. | ②③④ | C. | ②③④⑥ | D. | ①②④ |
18.下列叙述错误的是( )
| A. | 带相反电荷离子之间的相互吸引称为离子键 | |
| B. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| C. | 某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键 | |
| D. | 非金属原子间不可能形成离子键,存在离子键的化合物一定是离子化合物 |
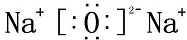 ;水溶液PH=8,则C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精确值).
;水溶液PH=8,则C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精确值).