题目内容
4.已知X、Y为同周期主族元素,且电负性x>Y,下列说法一定错误的是( )| A. | 原子半径:X<Y | |
| B. | 第一电离能:X>Y | |
| C. | 气态氢化物的稳定性:HmY小于HnY | |
| D. | X与Y形成化合物时,一般显负价,Y显正价 |
分析 X、Y元素同周期,且电负性X>Y,则非金属性X>Y,
A.同周期从左到右非金属性增强,原子半径减小;
B.一般非金属性强的,其第一电离能大;
C.非金属性越强,气态氢化物越稳定;
D.电负性大的元素在化合物中显负价;
解答 解:A.同周期从左到右非金属性增强,原子半径减小,所以子半径:X<Y,故A正确;
B.一般非金属性强的,其第一电离能大,则第一电离能Y可能小于X,故A正确;
C.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:HmY小于HnX,故C错误;
D.电负性大的元素在化合物中显负价,所以X和Y形成化合物时,X显负价,Y显正价,故A正确;
故选:C.
点评 本题考查位置、结构、性质,明确同周期位置关系及电负性大小得出元素的非金属性是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
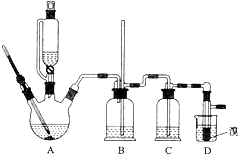
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收A中反应可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收A中反应可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
19.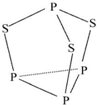 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )| A. | 该物质中磷元素的化合价为+3 | |
| B. | 该物质分子中不含非极性共价键 | |
| C. | 该物质的熔、沸点比P4低 | |
| D. | 该物质22 g含硫原子的数目约为1.806×1023 |
9.在硼酸[B(OH)3 ]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构.则晶体中同层分子间的主要作用力是( )
| A. | 范德华力 | B. | 共价键 | C. | 氢键 | D. | 离子键 |
16.根据下表中五种元素的电离能数据(单位:kJ•mol-1),下列说法不正确的是( )
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| u | 420 | 3100 | 4400 | 5900 |
| A. | T的氯化物最可能的化学式为TCl3 | |
| B. | 氦元素最有可能与Q元素位于同一族 | |
| C. | 在同周期表中,最可能处于同一族的是R和U | |
| D. | U元素最有可能为K,R元素最有可能为Li |
13.20世纪70年代末,由于高压技术的发展,一些实验室能使氢在-268.8℃、1.013×107 Pa下变成能导电的固态“金属氢”.关于氢的下列说法中,错误的是( )
| A. | 氢是宇宙物质中含量最多的元素 | |
| B. | 氢是名副其实的碱金属元素 | |
| C. | 氢气是无污染的新型能源 | |
| D. | 固态“金属氢”汽化的过程属于物理变化 |
14.核反应堆中存在三种具有放射性的微粒${\;}_{94}^{238}$X、${\;}_{94}^{240}$Y、${\;}_{92}^{238}$Z,下列说法正确的是( )
| A. | ${\;}_{94}^{238}$X与${\;}_{94}^{240}$Y互为同素异形体 | |
| B. | ${\;}_{94}^{238}$X与${\;}_{92}^{238}$Z互为同素异形体 | |
| C. | ${\;}_{94}^{240}$Y与${\;}_{92}^{238}$Z具有相同中子数 | |
| D. | ${\;}_{94}^{238}$X与${\;}_{92}^{238}$Z具有相同化学性质 |
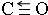 .NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.
.NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.