题目内容
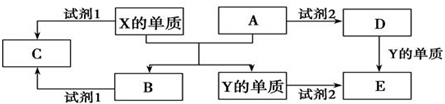
7.有一无色干燥的混合气体,可能是由HCl、NO、NO2、CO2、CO、NH3、H2、O2、N2中的几种混合而成,根据①把混和气体通过浓H2SO4时,气体体积明显减小.②再通入过量碱石灰时,体积又明显减小;③剩余气体接触空气时,立即变为红棕色,可得:混和气体中一定存在NH3、CO2、NO,一定不存在NO2、O2、HCl,可能存在H2、N2、CO.分析 无色干燥的混合气体,不含NO2,混合气体通过浓硫酸时,气体体积明显减小,说明一定存在氨气,一定不存在氯化氢,再通过碱石灰时,体积又明显减小,说明一定存在二氧化碳,剩余气体接触空气时,立即变为红棕色,说明一定存在一氧化氮,一定不存在氧气,氢气、N2、CO可能存在,据此解答.
解答 解:NO2是红棕色气体,混合气体无色,所以一定不存在NO2;
氨气能够与浓硫酸、氯化氢反应,混合气体通过浓硫酸时,气体体积明显减小,说明一定含有氨气,一定不存在HCl;
碱石灰能够吸收二氧化碳或者氯化氢,再通过碱石灰时,体积又明显减小,由于不存在氯化氢,则一定存在CO2气体;
一氧化氮能够与氧气反应生成红棕色二氧化氮,剩余气体接触空气时,立即变为红棕色,说明一定含有一氧化氮,不含氧气;
所以原混合气体中一定含有的气体为:NH3?CO2?NO;
一定不存在的气体为:HCl?NO2?O2;
可能存在气体为:H2、N2、CO
故答案为:NH3、CO2、NO,NO2、O2、HCl,H2、N2、CO.
点评 本题考查了常见气体的检验,反应过程和反应现象,掌握常见气体的物理性质、化学性质及检验方法是解题关键,题目难度中等.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
17.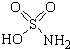 氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )
氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )
 氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )
氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )| A. | 不溶于水 | B. | 不能清洗铁锈 | ||
| C. | 水溶液中以分子形式大量存在 | D. | 与水反应生成的盐是NH4HSO4 |
18.下列变化中需加入氧化剂才能实现的是( )
| A. | H2S→SO2 | B. | Fe2+→Fe | C. | CO→CO2 | D. | 2H+→H2 |
2.将Cu片放入0.1mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中的C(Fe3+):C(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为( )
| A. | 5:3 | B. | 4:3 | C. | 3:4 | D. | 3:5 |
19.下列离子方程式中正确的是( )
| A. | 向NaSiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| B. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| C. | 碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | |
| D. | 氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
16.某同学在实验报告中记录下列数据,其中正确的是( )
| A. | 用25mL量筒量取12.36mL浓硫酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 用500mL的容量瓶配制500mL0.2 mol/L盐酸溶液 | |
| D. | 用广泛pH试纸测得某溶液的pH为2.5 |
17.下列说法正确的是( )
| A. | 氧化还原反应中一定有电子得失 | B. | 凡是能电离出H+的化合物均属于酸 | ||
| C. | 离子反应不一定是氧化还原反应 | D. | 置换反应不一定是氧化还原反应 |