题目内容
19.下列离子方程式中正确的是( )| A. | 向NaSiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| B. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| C. | 碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | |
| D. | 氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
分析 A.反应生成硅酸沉淀和亚硫酸氢钠;
B.反应生成硝酸铁、NO和水;
C.水解分别进行,以第一步为主;
D.遵循电子和电荷守恒.
解答 解:A.向NaSiO3溶液中通入过量SO2的离子反应为SiO32-+2SO2+2H2O═H2SiO3↓+2HSO3-,故A错误;
B.向稀硝酸中加入少量铁粉的离子反应为Fe+4H++NO3-═Fe3++NO↑+2H2O,故B错误;
C.碳酸钠的水解的离子反应为CO32-+H2O?HCO3-+OH-,故C错误;
D.氢氧化铁溶于氢碘酸的离子反应为2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.常温下加入下列物质,能使溶液中c(CO32-)、c(HCO3-)均降低,而pH增大的是( )
| A. | 氢氧化钠溶液 | B. | 通入二氧化碳 | C. | 氢氧化钙溶液 | D. | 盐酸 |
10.为检验某溶液中是否含有SO42-、NH4+、Cl-、Fe3+等四种离子,某同学进行了下图所示的实验操作,已知检验过程中产生的气体能使湿润红色石蕊试纸变蓝.由该实验能得到的正确结论是( )


| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
14.某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体.现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断中正确的是( )
| A. | 肯定有SO2、NO、O2 | B. | 肯定没有C12、O2和NO2 | ||
| C. | 可能有Cl2和O2 | D. | 肯定只有NO |
11.有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复).
已知:①A、C溶液的pH均大于7,四种物质的溶液中只有A、B的溶液中水的电离程度均大于纯水的电离程度;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象.
(1)A是CH3COONa,B是NH4Cl(填化学式).
(2)写出C和D反应的离子方程式Ba2++SO42-=BaSO4↓.
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(4)在一定体积的0.005mol•L-1的C溶液中,加入一定体积的0.00125mol•L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是1:4.
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
(1)A是CH3COONa,B是NH4Cl(填化学式).
(2)写出C和D反应的离子方程式Ba2++SO42-=BaSO4↓.
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(4)在一定体积的0.005mol•L-1的C溶液中,加入一定体积的0.00125mol•L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是1:4.
9.化学与生产、生活密切相关.下列叙述不正确的是( )
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 石英可用于制作光导纤维,光导纤维遇强碱会“断路” | |
| C. | 清晨阳光穿过林木枝叶铺洒地面属于丁达尔现象 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
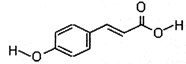
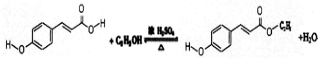 .
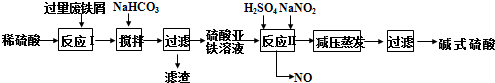
.
 [Fe2(OH)4]2++2H+.
[Fe2(OH)4]2++2H+.