题目内容
16.某同学在实验报告中记录下列数据,其中正确的是( )| A. | 用25mL量筒量取12.36mL浓硫酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 用500mL的容量瓶配制500mL0.2 mol/L盐酸溶液 | |
| D. | 用广泛pH试纸测得某溶液的pH为2.5 |
分析 A.量筒精确到0.1mL;
B.托盘天平精确到0.1g;
C.容量瓶的规格和所配制的溶液的体积进行选择分析;
D.广泛pH试纸的精确度只能达到整数.
解答 解:A、量筒量取时能精确到0.1mL,无法量取12.36ml盐酸,故A错误;
B、天平可精确到0.1g,不能用托盘天平称取8.75g氯化钠,故B错误;
C、容量瓶的规格和所配制的溶液的体积相符,可配制500mL0.2 mol/L盐酸溶液,故C正确;
D、广泛pH试纸测得溶液的pH值应是整数,无法测得某溶液的pH为2.5,故D错误.
故选C.
点评 本题考查中学化学中常用仪器在使用中读数的问题,容量瓶的使用方法,熟悉不同仪器的精确度不同,只要熟练掌握基本知识便可解决,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
11.有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复).
已知:①A、C溶液的pH均大于7,四种物质的溶液中只有A、B的溶液中水的电离程度均大于纯水的电离程度;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象.
(1)A是CH3COONa,B是NH4Cl(填化学式).
(2)写出C和D反应的离子方程式Ba2++SO42-=BaSO4↓.
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(4)在一定体积的0.005mol•L-1的C溶液中,加入一定体积的0.00125mol•L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是1:4.
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
(1)A是CH3COONa,B是NH4Cl(填化学式).
(2)写出C和D反应的离子方程式Ba2++SO42-=BaSO4↓.
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(4)在一定体积的0.005mol•L-1的C溶液中,加入一定体积的0.00125mol•L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是1:4.
5.如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为:PbO2+Pb+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )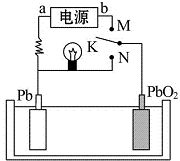

| A. | K与N相接时,Pb电极的反应式为Pb-2e-→Pb2+ | |
| B. | K与N相接时,SO42-向PbO2电极迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
6.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是( )
| A. | NH4+、SO42-、CO32-、K+ | B. | Na+、Ba2+、Ca2+、HCO3- | ||
| C. | Mg2+、Ag+、K+、Cl- | D. | K+、Cl-、Na+、SO42- |
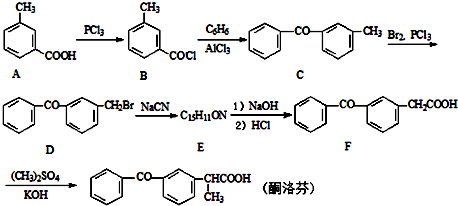
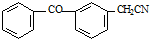 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应.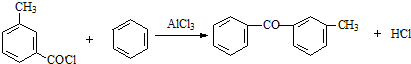 .
. .
.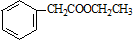 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH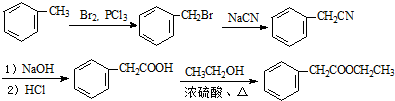 .
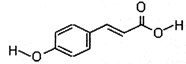
.
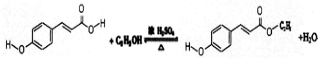 .
.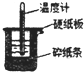 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
 [Fe2(OH)4]2++2H+.
[Fe2(OH)4]2++2H+.