题目内容
2.氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂(主要成分Na2B4O7)为起始物,经过一系列反应可以得到BN和有机合成催化剂BF3的过程如下.请根据题意回答下列问题:(1)写出由B2O3制备BF3的化学方程式B2O3+3CaF2+3H2SO4=2BF3↑+3CaSO4+3H2O,BF3中B原子的杂化轨道类型为sp2,BF3分子空间构型为平面正三角形.
(2)在硼、氧、氟、氮中第一电离能由大到小的顺序是(用元素符号表示)F>N>O>B.
(3)已知:硼酸的电离方程式为H3BO3+H2O?[B(OH)4]-+H+,试依据上述反应写出[B(OH)4]-的结构式
 ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.(4)由12个硼原子构成如图1的结构单元,硼晶体的熔点为1873℃,则硼晶体的1个结构单元中含有30个B-B键.

(5)氮化硼(BN)晶体有多种相结构.六方相氮化硼(晶体结构如图2)是通常存在的稳定相,可作高温润滑剂.立方相氮化硼(晶体结构如图3)是超硬材料,有优异的耐磨性.
①关于这两种晶体的说法,不正确的是ad(填字母).
a.两种晶体均为分子晶体
b.两种晶体中的B-N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体内B-N键数与硼原子数之比为3:1,其结构与石墨相似却不导电,原因是立方氮化硼晶体内无自由移动的电子.
③立方相氮化硼晶体中,每个硼原子连接12个六元环.该晶体的天然矿物在青藏高原地下约300km的古地壳中被发现.根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是高温、高压.
分析 (1)由图及元素守恒可写出由B2O3制备BF3的方程式;根据价层电子对互斥理论确定构型和杂化方式;
(2)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
(3)在[Al(OH)4]-中Al采取sp3杂化,用最外层的四个空轨道接受O提供的孤对电子形成配合物,一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,据此计算;
(4)在硼原子组成的正二十面体结构中,每5个面共用一个顶点,每个等边三角形拥有的顶点为:$\frac{1}{5}$×3=$\frac{3}{5}$,20个等边三角形拥有的顶点为:$\frac{3}{5}$×20=12,每2个面共用一个B-B键;
(5)①a.由图可知立方相氮化硼是立体网状结构,为原子晶体;
b.非金属元素之间易形成共价键;
c.六方相氮化硼为层状结构,层间为分子间作用力,作用力小;
d.立方相氮化硼含有σ键不存在π键;
②六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,该物质的层状结构中不存在自由移动的电子;
③氮化硼与碳元素的单质相似,结合金刚石的结构进行判断,立方相氮化硼晶体中,每个硼原子连接12个六元环,在地壳内部,离地面越深,其压强越大、温度越高.
解答 解:(1)B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水,方程式为:B2O3+3CaF2+3H2SO4=2BF3↑+3CaSO4+3H2O,BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(0-3×1)=0,中心原子B原子的价层电子对数为3,属于sp2杂化,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,BF3分子为平面三角形,
故答案为:B2O3+3CaF2+3H2SO4=2BF3↑+3CaSO4+3H2O;sp2;平面正三角形;
(2)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,B、N、O、F元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O,B的第一电离能最小,第一电离能由大到小的顺序是:F>N>O>B,
故答案为:F>N>O>B;
(3)在[Al(OH)4]-中Al采取sp3杂化,用最外层的四个空轨道接受O提供的孤对电子形成配合物,其结构式为 ,一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,则1mol NH4BF4含有2mol配位键,即2NA个配位键,
,一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,则1mol NH4BF4含有2mol配位键,即2NA个配位键,
故答案为: ;2NA;
;2NA;
(4)在硼原子组成的正二十面体结构中,每5个面共用一个顶点,每个面拥有这个顶点的:$\frac{1}{5}$×3=$\frac{3}{5}$,20个等边三角形拥有的顶点为:$\frac{3}{5}$×20=12,每2个面共用一个B-B键,每个面拥有这个B-B键的$\frac{1}{2}$,每个等边三角形占有的B-B键为:$\frac{1}{2}$×3=$\frac{3}{2}$,20个等边三角形拥有的B-B键为:$\frac{3}{2}$×20=30,
故答案为:30;
(5)①(2)a.立方相氮化硼为空间网状结构,不存在分子,为原子晶体,故a错误;
b.非金属元素之间易形成共价键,所以N原子和B原子之间存在共价键,故b正确;
c.六方相氮化硼层间为层状结构,分子间作用力,作用力小,导致其质地软,故c正确;
d.立方相氮化硼N原子和B原子之间存在共价单键,所以该化合物中含有σ键不存在π键,故d错误;
故选ad;
②六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,六方相氮化硼晶体内B-N键数与硼原子数之比为3:1,该物质的层状结构中不存在自由移动的电子,所以不导电,
故答案为:3:1;立方氮化硼晶体内无自由移动的电子;
③氮化硼与金刚石的结构相似,立方相氮化硼晶体中,每个硼原子连接12个六元环,在地壳内部,离地面越深,其压强越大、温度越高,根据题干知,实验室由六方相氮化硼合成立方相氮化硼需要的条件应是高温高压,
故答案为:12;高温、高压.
点评 本题考查了物质结构和性质,涉及第一电离能、原子的杂化方式、晶体的计算等知识点,侧重于学生的分析能力和计算能力的考查,这些知识点都是高考热点,注意价层电子对互斥理论确定原子杂化方式及分子空间构型、晶胞的计算,题目难度中等.

 阶梯计算系列答案
阶梯计算系列答案| A. | X极为负极,Y极为正极 | |
| B. | 工作一段时间后,KOH的物质的量不变 | |
| C. | 电池工作时甲烷一极附近溶液的pH减小 | |
| D. | 该在标准状况下通入5.6 L O2完全反应,则有1.0mol电子发生转移 |
| A. | 我国2015年玉月1日正式实施的《环境保护法》被称为“史上最严”环保法,为保护好环境,工业生产应从源头上减少或尽量消除生产对环境的污染 | |
| B. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯 等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| C. | 世界卫生组织认为青蒿素(结构如右图所示)联合疗法是当下治疗疟疾最 有效的手段,已经拯救了上百万生命,靑蒿素属于烃类物质 | |
| D. | 某品牌化妆品在广告中反复强调:“十年专注自然护肤”,该产品中不含任何化学成分 |
| A. | 可用作荧光灯内壁保护层的氧化铝纳米材料属于胶体 | |
| B. | 高分子材料可能导电,如聚乙炔 | |
| C. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 | |
| D. | 人造刚玉的主要成分是MgO,熔点很高,可用作高级耐火材料 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入足量的稀Fe(NO3)3溶液 | 溶液由棕黄色变为浅绿色,但立即又变成棕黄色 | 氧化性:HNO3>稀硫酸>Fe3+ |
| B | 相同条件下,测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| C | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红色 | 氧化铜被酒精灯内焰的乙醇蒸汽还原 |
| D | 取适量NH4Al(SO4)2样品置于试管中加水溶解,滴加少量稀NaOH溶液 | 湿润的红色石蕊试纸靠近试管口,试纸变蓝 | NH4Al(SO4)2溶液中存在NH4+ |
| A. | A | B. | B | C. | C | D. | D |
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是BaSO4.
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2.
①支持甲同学观点的实验证据是液面上方略显浅棕色.
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO+4H+.
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
| 实验操作 | 实验现象 |
| 向2mL 0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2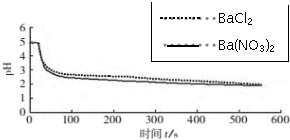 |
(4)图2,BaCl2溶液中发生反应的离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+.
(5)依据上述图象你得出的结论是在氧化SO2的过程中,O2起了主要作用.
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
| A. | 碳碳键键长:乙烯>苯 | B. | 密度:一氯乙烷>一氯丁烷 | ||
| C. | 热稳定性:NaHCO3>Na2CO3>H2CO3 | D. | 沸点:H2O>H2S>H2Se |