题目内容
11.化学与生活、社会发展息息相关,下列说法不正确的是( )| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
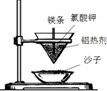
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
分析 A.气溶胶属于胶体,有丁达尔效应;
B.依据湿法炼铜原理解答;
C.青蒿素的提取用的是低温萃取,属于物理方法;
D.合金是指金属与非金属或者金属融合而成具有金属性质的材料.
解答 解:A.雾霾所形成的气溶胶属于胶体,胶体都具有丁达尔效应,故A正确;
B.铁活泼性强于铜,铁置换铜属于湿法炼铜,该过程发生了置换反应,故B正确;
C.青蒿素的提取用的是低温萃取,没有新物质生成,属于物理方法,故C错误;
D.铁中含碳量越高,硬度越大,含碳量越少,韧性越强,剂钢是铁与碳的合金,故D正确;
故选:C.
点评 本题考查了化学与生活、社会关系,涉及胶体的性质、物理变化与化学变化的判断、合金的性质,题目难度不大,掌握基础是解题关键.

练习册系列答案
相关题目
19.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 17g羟基和17gOH-含有的电子数均为10NA | |
| B. | 2L0.5 mol•L-1醋酸溶液中含有的H+数为NA | |
| C. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4L | |
| D. | 7.8gNa2O2与足量的CO2和H2O(g)混合气体充分反应,转移的电子数为0.1NA |
6.下列说法正确的是( )
| A. | 乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| B. | 烃与卤素单质之间的反应均为加成反应 | |
| C. | 多糖、油脂均可发生水解反应 | |
| D. | 石油分馏和裂化均为物理变化 |
16.新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
②LiBH4由Li+和BH4-构成,BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3.
Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是Mg (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为142pm,NaH的理论密度是$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$g•cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
②LiBH4由Li+和BH4-构成,BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3.
Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为142pm,NaH的理论密度是$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$g•cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
3.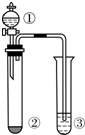 下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )
下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )
 下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )
下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 水 | 电石 | CuSO4溶液 | 乙炔具有还原性 |
| B | 浓硝酸 | Cu | KI-淀粉溶液 | 氧化性:NO2>KI |
| C | 浓盐酸 | KMnO4 | KI-淀粉溶液 | 氧化性:KMnO4>Cl2>I2 |
| D | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | 溶解度:AgCl>Ag2S |
| A. | A | B. | B | C. | C | D. | D |
1.氢气是化工行业重要原料之一.
(1)电解饱和食盐水是生产H2的方法之一.常温下,电解200mL饱和食盐水一段时间后,溶液质量减轻0.73g(假设气体全部逸出).生产氢气在标准状况下的体积为224mL.
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1m3甲烷此过程生成0.24m3氢气,则甲烷的裂解率为16%(体积均在相同条件下测定).
(3)已知:CxH7+H2O→CO+CO2+H2(未配平).工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如表所示.
计算原混合气体中甲烷与乙烷的物质的量之比.
(4)合成氨生产过程中,消耗氮氢混合气2800m3(其中CH4的体积分数为0.2%,下同),分离液氨后的氮氢混合气中含CH43%.计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况).
(1)电解饱和食盐水是生产H2的方法之一.常温下,电解200mL饱和食盐水一段时间后,溶液质量减轻0.73g(假设气体全部逸出).生产氢气在标准状况下的体积为224mL.
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1m3甲烷此过程生成0.24m3氢气,则甲烷的裂解率为16%(体积均在相同条件下测定).
(3)已知:CxH7+H2O→CO+CO2+H2(未配平).工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如表所示.
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
(4)合成氨生产过程中,消耗氮氢混合气2800m3(其中CH4的体积分数为0.2%,下同),分离液氨后的氮氢混合气中含CH43%.计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况).
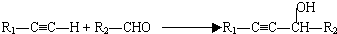 (R代表烃基,下同.)
(R代表烃基,下同.)
 .
. ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.