题目内容
1.重铬酸钾是中学化学重要的氧化剂.为了测定某重铬酸钾溶液的浓度,进行如下实验.①在VmL FeSO4溶液中滴加适量稀硫酸,再滴加VmL 0.1mol•L-1H2O2溶液恰好完全反应(H2O2→H2O);
②在VmL K2Cr2O7(用稀硫酸酸化)溶液中滴加3VmL FeSO4溶液恰好完全反应(Cr2O72-→Cr3+).
则该重铬酸钾溶液的浓度(mol•L-1)为( )
| A. | 0.1 | B. | 0.2 | C. | 0.3 | D. | 0.5 |
分析 ①在VmL FeSO4溶液中滴加适量稀硫酸,再滴加VmL 0.1mol•L-1H2O2溶液恰好完全反应(H2O2→H2O),离子反应方程式为2Fe2++2H++H2O2=2Fe 3++2H2O;
②在VmL K2Cr2O7(用稀硫酸酸化)溶液中滴加3VmL FeSO4溶液恰好完全反应(Cr2O72-→Cr3+),
则VmLFeSO4溶液能和$\frac{1}{3}$VmLK2Cr2O7完全反应,
离子方程式为Cr2O72-+14H++6Fe 2+=6Fe 3++2Cr 3++7H2O,
根据方程式2Fe2++2H++H2O2=2Fe 3++2H2O、Cr2O72-+14H++6Fe 2+=6Fe 3++2Cr 3++7H2O得关系式
3H2O2----Cr2O72-,根据关系式计算重铬酸钾的物质的量浓度.
解答 解:①在VmL FeSO4溶液中滴加适量稀硫酸,再滴加VmL 0.1mol•L-1H2O2溶液恰好完全反应(H2O2→H2O),离子反应方程式为2Fe2++2H++H2O2=2Fe 3++2H2O;
②在VmL K2Cr2O7(用稀硫酸酸化)溶液中滴加3VmL FeSO4溶液恰好完全反应(Cr2O72-→Cr3+),
则VmLFeSO4溶液能和$\frac{1}{3}$VmLK2Cr2O7完全反应,
离子方程式为Cr2O72-+14H++6Fe 2+=6Fe 3++2Cr 3++7H2O,
根据方程式2Fe2++2H++H2O2=2Fe 3++2H2O、Cr2O72-+14H++6Fe 2+=6Fe 3++2Cr 3++7H2O得关系式
3H2O2----Cr2O72-,
设重铬酸钾的物质的量浓度是xmol/L
3H2O2----Cr2O72-,
3 1
(0.1×10-3 V )mol ($\frac{1}{3}$V×10-3x)mol
3:1=(0.1×10-3 V )mol:($\frac{1}{3}$V×10-3x)mol
V=$\frac{1×(0.1×1{0}^{-3}V)mol}{3×(\frac{1}{3}V×1{0}^{-3})mol}$=0.1,
故选A.
点评 本题以物质的量浓度为载体考查化学方程式有关计算,为高频考点,正确书写离子方程式且找出双氧水和重铬酸钾的关系式是解本题关键,注意等量代换,题目难度中等.

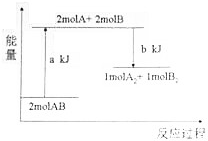
| A. | 该反应是放热反应 | |
| B. | 该反应一定要在加热条件下才能进行 | |
| C. | 断开lmolA2中的化学键和lmolB2中的化学键需吸收akJ的能量 | |
| D. | 1moIA2和1moIB2的总能量高于2molAB的总能量 |
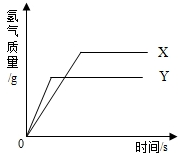 现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知X、Y在生成物中化合价均为+2价).则下列说法中不正确的是( )
现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知X、Y在生成物中化合价均为+2价).则下列说法中不正确的是( )| A. | 生成氢气的质量:X>Y | B. | 相对原子质量:X>Y | ||
| C. | 金属活动性:Y>X | D. | 消耗硫酸的质量:X>Y |
| A. | 烟 | B. | 雾 | C. | 食用油滴入水中 | D. | KNO3溶于水 |
| A. | 质量比为11:8 | B. | 原子个数之比为2:3 | ||
| C. | 物质的量之比为3:2 | D. | 密度之比为8:11 |
[滴定时,1mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ称取样品1.500g.
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ量取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)步骤Ⅱ中除容量瓶还需要烧杯、玻璃棒、胶头滴管玻璃仪器
(2)根据步骤Ⅲ填空:
①量取样品溶液用酸式滴定管(填酸式或碱式)②滴定管用蒸馏水洗涤后,直接量取样品溶液,则测得样品中氮的质量分数偏低(填“偏高”、“偏低”或“无影响”).③装标准液的滴定管在滴定前有气泡,滴定后气泡消失;则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
④滴定达到终点时,现象溶液刚好由无色变为浅红色,且半分钟内不褪色
(3)滴定结果如表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.05 |
| 2 | 25.00 | 2.00 | 22.01 |
| 3 | 25.00 | 0.50 | 21.50 |
| 4 | 25.00 | 0.20 | 20.22 |
| A. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| B. | 将煤进行气化处理,提高煤的综合利用效率 | |
| C. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用观,即:减少资源消耗、增加资源的重复使用、资源的循环再生 |
| A. | “碘盐”宜密封保存 | |
| B. | “碘盐”就是“I2+NaCl” | |
| C. | 使用“碘盐”时不宜高温煎炒 | |
| D. | 食用加碘盐,以确保人体对碘的摄入量 |
| A. | 根据氧化物的性质可将氧化物分成酸性氧化物、碱性氧化物、两性氧化物和特殊氧化物等 | |
| B. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据分散质粒子直径大小可将液体分散系分为溶液、胶体和浊液 | |
| D. | 根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质 |