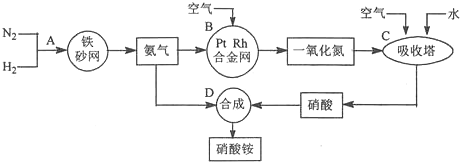
题目内容
17.24.5g H2SO4的物质的量是0.25mol,内含0.25NA个H2SO4分子.分析 根据n=$\frac{m}{M}$计算出硫酸的物质的量,然后根据N=nNA计算出含有硫酸分子的数目.
解答 解:24.5g H2SO4的物质的量是:n(H2SO4)=$\frac{24.5g}{98g/mol}$=0.25mol,0.25mol硫酸中含有0.25NA个H2SO4分子,
故答案为:0.25mol;0.25NA.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列物质中,只含有共价键的是( )
| A. | Na2O | B. | CO2 | C. | KCl | D. | NaOH |
8.下列关于苯的说法中错误的是( )
| A. | 苯是一种无色、有特殊气味的液体 | |
| B. | 苯在空气中燃烧有浓烟 | |
| C. | 苯不能使酸性KMnO4溶液褪色 | |
| D. | 苯与浓硝酸混合立即剧烈反应生成硝基苯 |
5.下列物质分子中,所有原子都处于同一平面内的是( )
| A. | CH4 | B. | C6H6 | C. | CH3-CH3 | D. | CH3Cl |
9.在BaCl2溶液中通入SO2气体,溶液仍澄清.若将BaCl2溶液分别盛在两支试管,一支加HNO3,另一支加NaOH溶液,再通入SO2气体,结果两支试管均有白色沉淀.由此,下列结论合理的是( )
| A. | BaCl2有两性 | |
| B. | 两试管沉淀均是BaSO3 | |
| C. | SO2有还原性,酸性 | |
| D. | 升高PH,使SO2水溶液中SO32-浓度增大 |
6.下列物质溶于水后由于水解而显酸性的是( )
| A. | NaHSO4 | B. | NaHCO3 | C. | FeCl3 | D. | CH3COOH |
7.下列说法中正确的是( )
| A. | 6.8 g熔融KHSO4 与3.9 g熔融Na2O2 中阴离子数目相同 | |
| B. | 某金属阳离子的结构示意图为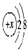 ,其与Cl-形成的强电解质都是离子化合物 ,其与Cl-形成的强电解质都是离子化合物 | |
| C. | 二硫化碳与二氧化碳结构相似,其电子式为 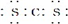 | |
| D. | 中子数为18的氯原子可表示为18Cl |
 .
.