题目内容
在标准状况下,称量一个充满Cl2的容器质量为74.6g,若改充氮气,其质量为66g,则容器充满SO2气体时的质量为( )
| A、64.8 g |
| B、73.2 g |
| C、68.6 g |
| D、75.8 g |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:相同条件下,氯气和氮气的体积相等,等于容器的体积,则氯气和氮气的物质的量相等,假设气体的物质的量为n,容器的质量为m,根据不同气体的质量,列方程进行相关计算n值,进而可计算容器充满SO2气体时的质量.
解答:
解:假设气体的物质的量为nmol,容器的质量为mg,则:
mg+nmol×71g/mol=74.6g,
mg+nmol×28g/mol=66g,
联立方程,解得n=0.2mol,m=60.4g,
SO2气体的质量为0.2mol×64g/mol=12.8g,
则容器充满SO2气体时的质量为12.8g+60.4g=73.2g,
故选B.
mg+nmol×71g/mol=74.6g,
mg+nmol×28g/mol=66g,
联立方程,解得n=0.2mol,m=60.4g,
SO2气体的质量为0.2mol×64g/mol=12.8g,
则容器充满SO2气体时的质量为12.8g+60.4g=73.2g,
故选B.
点评:本题考查了阿伏伽德罗定律及其推论,明确相同条件下相同体积的不同气体的物质的量相等,再结合质量与物质的量、摩尔质量的关系来分析解答,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
短周期元素甲、乙、丙、丁的原子序数依次增大,甲是周期表中原子半径最小的元素,乙的单质在暗处与甲的单质剧热反应化合并发生爆炸,甲和丙同主族,丁的最外层电子数和电子层数相等,则( )
| A、原子半径:丙>丁>乙 |
| B、甲与丙的原子核外电子数相差8 |
| C、丙的单质在空气中燃烧生成只含离子键的化合物 |
| D、最高价氧化物对应的水化物的碱性:丙>丁 |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、1mol羟基的电子数目为10NA |
| B、常温,32g氧气和臭氧的混合物含氧原子素数共2NA |
| C、标准状况下,11.2L的HF所含的分子数为0.5NA |
| D、2mol Na2O2与足量的水反应转移电子数为4NA |
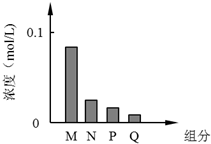 常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )
常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )| A、图中N表示HA,P表示OH-,Q表示H+ |
| B、若V=10 mL,则pH=7 |
| C、若V<10 mL,则溶液显酸性 |
| D、若V=10 mL,则:c(M)+c(P)=c(Na+) |
下列有关物质的结构或性质的叙述错误的是( )
| A、水是一种非常稳定的化合物,这是由于氢键所致 |
| B、由极性键形成的分子不一定是极性分子 |
| C、H2O、HF、NH3、CH4的沸点依次降低 |
| D、分子晶体中一定存在分子间作用力,可能有共价键 |
下列化工生产过程不是氧化还原反应的是( )
| A、氮气与氢气合成氨 |
| B、氨气为原料制硝酸 |
| C、磷矿石跟硫酸制磷肥 |
| D、铁矿石炼制生铁 |
用某仪器量一液体体积时,平视时读数为nml,仰视时读数为xml,俯视时读数为yml,若x>n>y,则所用的仪器可能是( )
| A、量筒 | B、酸式滴定管 |
| C、碱式滴定管 | D、容量瓶 |



