题目内容
下列陈述I、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述Ⅱ |
| A | 明矾溶于水能产生Al(OH)3胶体, Al(OH)3胶体具有吸附性 | 明矾常用于对自来水进行杀菌消毒 |
| B | SO2有还原性 | SO2尾气可用NaOH溶液吸收 |
| C | NO是一种无色不溶于水的气体, NO遇空气会迅速变成红棕色 | 收集NO气体需用排水法,不能用排空气法 |
| D | Na有还原性 | 电解NaCl饱和溶液可制备Na |
| A、A | B、B | C、C | D、D |
考点:二氧化硫的化学性质,氮的氧化物的性质及其对环境的影响,钠的化学性质,镁、铝的重要化合物
专题:元素及其化合物
分析:A.明矾不具有强氧化性;
B.二氧化硫与NaOH发生复分解反应;
C.NO与氧气反应,NO不能溶于水;
D.电解NaCl饱和溶液生成NaOH、氢气、氯气.
B.二氧化硫与NaOH发生复分解反应;
C.NO与氧气反应,NO不能溶于水;
D.电解NaCl饱和溶液生成NaOH、氢气、氯气.
解答:
解:A.明矾不具有强氧化性,溶于水能产生Al(OH)3胶体,Al(OH)3胶体具有吸附性,可净化水,但不能杀菌消毒,故A错误;
B.二氧化硫与NaOH发生复分解反应,体现其酸性氧化物的性质,与还原性无关,故B错误;
C.NO与氧气反应,NO不能溶于水,则收集NO气体需用排水法,不能用排空气法,所以陈述与因果关系均合理,故C正确;
D.电解NaCl饱和溶液生成NaOH、氢气、氯气,Na的还原性强,应利用电解熔融NaCl的方法,故D错误;
故选C.
B.二氧化硫与NaOH发生复分解反应,体现其酸性氧化物的性质,与还原性无关,故B错误;
C.NO与氧气反应,NO不能溶于水,则收集NO气体需用排水法,不能用排空气法,所以陈述与因果关系均合理,故C正确;
D.电解NaCl饱和溶液生成NaOH、氢气、氯气,Na的还原性强,应利用电解熔融NaCl的方法,故D错误;
故选C.
点评:本题考查物质的性质,综合考查元素化合物知识及化学反应原理,为高频考点,涉及知识点较多,综合性强,较好的训练学生的思维转换及解决问题的能力,题目难度不大.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
短周期元素甲、乙、丙、丁的原子序数依次增大,甲是周期表中原子半径最小的元素,乙的单质在暗处与甲的单质剧热反应化合并发生爆炸,甲和丙同主族,丁的最外层电子数和电子层数相等,则( )
| A、原子半径:丙>丁>乙 |
| B、甲与丙的原子核外电子数相差8 |
| C、丙的单质在空气中燃烧生成只含离子键的化合物 |
| D、最高价氧化物对应的水化物的碱性:丙>丁 |
根据有机物的命名原则,下列命名正确的是( )
A、 三甲苯 三甲苯 |
| B、CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
| C、CH3CH(NH2)CH2COOH α-氨基丁酸 |
D、 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
据最新科技报道,用10B合成的10B20有非常好的抗癌、治癌作用,下列有关说法正确的是( )
| A、10B和10B20互为同位素 |
| B、10B20是一种高熔点硬度大的物质 |
| C、10B和10B20互为同分异构体 |
| D、10B中子数与核外电子数相同 |
m克焦炭与x克氧气置于密闭容器中,在一定条件下充分反应后恢复到原来的温度,容器中反应物均无剩余.设反应前后压强分别为P1、P2,以下说法正确的是( )
| A、如果P1=P2,m≥3x/8 |
| B、如果2P1=P2,m≤3x/4 |
| C、如果P1<P2<2P1,3x/4>m>3x/8 |
| D、无论前后压强如何变化,m=3x/8 |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、1mol羟基的电子数目为10NA |
| B、常温,32g氧气和臭氧的混合物含氧原子素数共2NA |
| C、标准状况下,11.2L的HF所含的分子数为0.5NA |
| D、2mol Na2O2与足量的水反应转移电子数为4NA |
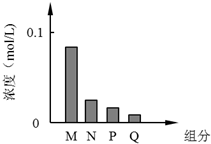 常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )
常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )| A、图中N表示HA,P表示OH-,Q表示H+ |
| B、若V=10 mL,则pH=7 |
| C、若V<10 mL,则溶液显酸性 |
| D、若V=10 mL,则:c(M)+c(P)=c(Na+) |