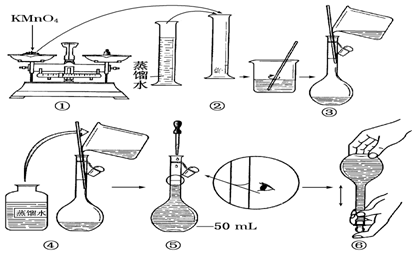
题目内容
18.为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是( )| 序号 | 物质 | 试剂 | 分离方法 |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 重结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 金属钠 | 蒸馏 |
| ④ | NaCl溶液(Na2S) | AgCl | 过滤 |
| A. | ①③ | B. | ①④ | C. | ② | D. | ③④ |
分析 ①硝酸钾和氯化钠的溶解度随温度的变化不同;
②二者都与碳酸钠溶液反应;
③二者都与水反应;
④硫化钠可与AgCl反应生成硫化银沉淀.
解答 解:①硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶的方法分离,故正确;
②二者都与碳酸钠溶液反应,应用饱和碳酸氢钠溶液除杂,故错误;
③二者都与水反应,应用蒸馏的方法分离,故错误;
④硫化钠可与AgCl反应生成硫化银沉淀,可用于除杂,故正确.
故选B.
点评 本题考查混合物分离提纯方法及选择,为高频考点,把握物质的性质及混合物分离方法为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
8.碳及其化合物有广泛的用途.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)═CO(g)+H2(g)△H>0,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O(g)的平衡转化率的是AD.
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)═CO2(g)+H2(g),得到如下数据:
通过计算求出该反应的平衡常数(计算结果保留两位有效数字).
(3)把水煤气中的混合气体经过处理后获得的较纯H2用于工业合成氨.已知:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2N2(g)+6H2O(l)═4NH3(g)+3O2(g)△H=+1530.0kJ/mol
①氢气的燃烧热△H=-285.8kJ/mol.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)═CO(g)+H2(g)△H>0,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O(g)的平衡转化率的是AD.
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)═CO2(g)+H2(g),得到如下数据:
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
(3)把水煤气中的混合气体经过处理后获得的较纯H2用于工业合成氨.已知:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2N2(g)+6H2O(l)═4NH3(g)+3O2(g)△H=+1530.0kJ/mol
①氢气的燃烧热△H=-285.8kJ/mol.
9.下列说法正确的是( )
| A. | 煤经处理变为气体燃料的过程属于物理变化 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 乙烷和乙醇均能发生取代反应 | |
| D. | 乙酸乙酯和植物油均可水解生成乙醇 |
6.一定条件下反应:2SO2+O2?2SO3 发生时,能使V(SO2)增大的措施有( )
①增大压强 ②降低压强 ③通入SO2 ④增加的O2量 ⑤升高温度 ⑥降低温度.
①增大压强 ②降低压强 ③通入SO2 ④增加的O2量 ⑤升高温度 ⑥降低温度.
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ②③④⑤ | D. | ①③④⑤ |
13.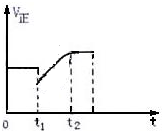 如图表示反应2SO2(g)+O2 $?_{加热}^{催化剂}$ 2SO3(g)+Q的正反应速率随时间的变化情况,试根据图曲线判断下列说法可能正确的是( )
如图表示反应2SO2(g)+O2 $?_{加热}^{催化剂}$ 2SO3(g)+Q的正反应速率随时间的变化情况,试根据图曲线判断下列说法可能正确的是( )
 如图表示反应2SO2(g)+O2 $?_{加热}^{催化剂}$ 2SO3(g)+Q的正反应速率随时间的变化情况,试根据图曲线判断下列说法可能正确的是( )
如图表示反应2SO2(g)+O2 $?_{加热}^{催化剂}$ 2SO3(g)+Q的正反应速率随时间的变化情况,试根据图曲线判断下列说法可能正确的是( )| A. | t1时只减小了压强 | |
| B. | t1时只降低了温度 | |
| C. | t1时增加了SO2和O2的浓度,平衡向正反应方向移动 | |
| D. | t1时减小SO2浓度的同时,增加了SO3的浓度 |