题目内容
16.分类是学习和研究化学的一种重要方法,下列分类合理的是( )| A. | K2CO3和K2O都属于钾盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Na2CO3都属于碱 | D. | Na2O和Na2CO3都属于氧化物 |
分析 电离时生成的阳离子全部是氢离子的化合物叫酸;电离时生成的阴离子全部是氢氧根离子的化合物叫碱;电离时生成金属离子和酸根离子的化合物叫盐;由两种元素组成其中一种是氧元素的化合物叫氧化物,据定义分析即可.
解答 解:A.K2CO3由碳酸根离子和钾离子构成属于盐,K2O是由氧离子和钾离子构成属于氧化物,故A错误;
B.H2SO4和HNO3都属于酸,故B正确;
C.KOH由钾离子和氢氧根离子构成属于碱,Na2CO3由碳酸根离子和钠离子构成属于盐,故C错误;
D.Na2O属于氧化物,Na2CO3由碳酸根离子和钠离子构成属于盐,故D错误;
故选B.
点评 本题考查了物质的分类,题目难度不大,注意把握物质分类标准以及酸碱盐和氧化物的概念,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
15.下列操作或装置能达到实验目的是( )
| A. | 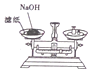 称取一定量的NaOH | |
| B. | 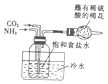 制取NaHCO3 | |
| C. | 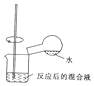 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 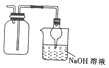 收集NO2丙防止其污染环境 |
7.下列离子方程式中不正确的是( )
| A. | 氢氧化钡溶液和硫酸钠溶液混合:Ba2++SO42-=BaSO4↓ | |
| B. | 将亚硫酸氢钠加入盐酸溶液中:HSO3-+H+=SO2↑+H2O | |
| C. | 氢硫酸与亚硫酸混合:H2SO3+2H2S=3S↓+3H2O | |
| D. | H2S气体通入CuSO4溶液中:Cu2++S2-=CuS↓ |
4.下列物质均有漂白作用,但其中一种的漂白原理与其它三种不同的是( )
| A. | HClO | B. | SO2 | C. | O3 | D. | H2O2 |
11.下列离子方程式正确的是( )
| A. | 醋酸与氢氧化钠溶液反应:OH-+H+═H2O | |
| B. | 氯气与水反应:Cl2+H2O?Cl-+HClO+H+ | |
| C. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ |
1.用下列装置进行相应实脸,不能达到实验目的是( )
| A. |  如图装置可用于制备氢氧化亚铁 | |
| B. |  如图装置可用于测定Na2CO3和NaHCO3混合物中NaHCO3的含量 | |
| C. |  如图装置可用于检验氨气溶于水后显碱性 | |
| D. |  如图装置可用于CaCO3和稀盐酸反应制取少量的CO2气体 |
8.pH相同的CH3COOH、HCl和H2SO4溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的pH仍然相同,则X、Y、Z的关系是( )
| A. | X=Y=Z | B. | X=Y<Z | C. | X>Y=Z | D. | X<Y=Z |
5.有未知浓度的Ba(OH)2和NaOH混合溶液,量取四份该溶液分别通入等量的CO2(已折算成标准状况下的体积,不考虑CO2在水中的溶解),生成沉淀的物质的量如表:
(1)该混合溶液中Ba(OH)2的物质的量浓度=1.50mol/L.
(2)实验Ⅲ最后所得溶液中碳酸钠的物质的量=0.0450mol.
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| CO2体积(mL) | 2352 | 2352 | 2352 | 2352 |
| 样品体积(mL) | 20.0 | 30.0 | 40.0 | 50.0 |
| 沉淀物质的量(×10-2mol) | 1.50 | 4.50 | 6.00 | 7.50 |
(2)实验Ⅲ最后所得溶液中碳酸钠的物质的量=0.0450mol.
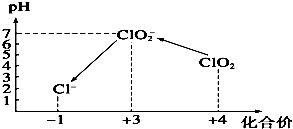 ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.