题目内容
16.已知20℃时,将5mL 0.1mol•L-1的Na2S3O3溶液和等体积、等浓度的稀H2SO4混合,9min后溶液中明显出现浑浊;50℃时,同样的反应要明显看到浑浊,仅需20s的时间.则温度每升高10℃,反应速率增大到原来的( )| A. | 5倍 | B. | 4倍 | C. | 3 倍 | D. | 2倍 |
分析 先计算出50℃时与20℃时反应速率的关系,设温度每升高10℃,反应速率增大到优先的x倍,温度由20℃升高到50℃,温度升高了30℃(3个10℃),则反应速率变成优先的x3倍,即:x3=27,据此进行计算.
解答 解:由题意可知,50℃时的反应速率是20℃时的$\frac{60×9s}{20s}$=27倍,
设温度每升高10℃,反应速率增大到优先的x倍,
温度由20℃升高到50℃,温度升高了30℃(3个10℃),则反应速率变成优先的x3倍,
即:x3=27,
解得:x=3,
故选C.
点评 本题考查反应速率的计算,题目难度中等,明确两个反应温度下反应速率的关系为解答关键,试题侧重考查学生的分析能力及知识迁移能力.

练习册系列答案
相关题目
6.科学家发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子.下列有关这两种粒子的说法不正确的是( )
| A. | “零号元素”在元素周期表中与氢元素占同一位置 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “四中子”不显电性 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
7.有关下列装置说法正确的是( )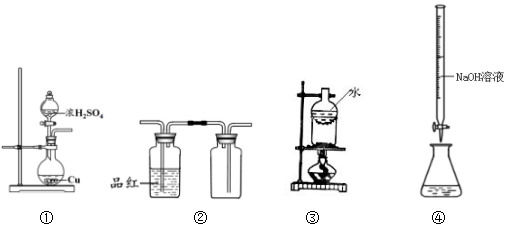

| A. | 用装置①制备SO2 | B. | 用装置②检验和收集SO2 | ||
| C. | 用装置③分离NaCl和I2 | D. | 用装置④测定溶液中c(H+) |
4.下列有关实验的设计可行的是( )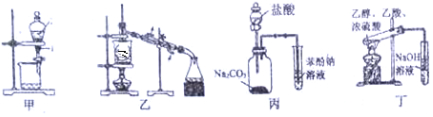

| A. | 装置甲:用CCl4萃取碘水中的碘 | |
| B. | 装置乙:用于从酒精水溶液中制取无水乙醇 | |
| C. | 装置丙:验证盐酸、碳酸、苯酚溶液的酸性 | |
| D. | 装置丁:用乙酸、乙醇制取乙酸乙酯 |
11. “天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
 “天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )| A. | c极上发生的电极反应是:O2+4H++4e-═2H2O | |
| B. | 当有0.1mol电子转移时,b极产生1.12L 气体Y(标准状况下) | |
| C. | 装置I与装置II的电解质溶液中,氢离子运动方向相反 | |
| D. | RFC系统工作过程中只存在3种形式的能量转化 |
1. 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS═Na2Sx,电池结构如图所示.下列说法不正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS═Na2Sx,电池结构如图所示.下列说法不正确的是( )
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS═Na2Sx,电池结构如图所示.下列说法不正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS═Na2Sx,电池结构如图所示.下列说法不正确的是( )| A. | 放电时,Na作负极,反应式为Na-e-=Na+ | |
| B. | 钠硫电池在常温下也能正常工作 | |
| C. | 放电时Na+向正极移动 | |
| D. | 当外电路通过0.25mol电子时消耗16g硫,则x=4 |
8.下列说法正确的是( )
| A. | CO2的电子式为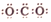 | |
| B. | 浓H2SO4试剂瓶上应贴上危险警告标签 | |
| C. | 根据分散质微粒直径大小,可将分散系分为浊液,胶体和溶液 | |
| D. | 核内打8个中子的碳原子可表示为86C |
5.下列说法中正确的是( )
| A. | 100g质量分数为46%的酒精水溶液中的氧原子数为4NA | |
| B. | 500mL 2mol/L碳酸钠溶液中的阴离子数小于NA | |
| C. | 合成氨反应中催化剂降低了反应的活化能,增大了反应的焓变 | |
| D. | 据“△H-T•△S<0”判断某反应能自发,可知该反应一定能发生 |
16.某位同学配制某温度下一定物质的量浓度的NH4HCO3溶液,结果所配溶液浓度偏低,可能原因是( )
| A. | 天平所配的砖码有脏污 | |
| B. | 药品保存不善,露置时间过长 | |
| C. | 定容时液面与容量瓶壁交界处到达刻度就定容完毕 | |
| D. | 溶解步骤完成后,洗涤次数过多 |