题目内容
下列有关金属腐蚀与防护的说法中,不正确的是( )
| A、温度越高,金属腐蚀越快 |
| B、金属被腐蚀的本质是发生了氧化反应 |
| C、将钢闸门与直流电源的正极相连可防止其被腐蚀 |
| D、在铁管上镀锌可防止其被腐蚀 |
考点:金属的电化学腐蚀与防护
专题:
分析:A、升高温度加快反应速率;
B、金属被腐蚀失电子被氧化;
C、与原电池的正极相连作阳极被腐蚀;
D、形成原电池时活泼性强的被腐蚀.
B、金属被腐蚀失电子被氧化;
C、与原电池的正极相连作阳极被腐蚀;
D、形成原电池时活泼性强的被腐蚀.
解答:
解;A、升高温度加快反应速率,所以温度越高,金属腐蚀速率越快,故A正确;
B、金属被腐蚀失电子被氧化,则金属被腐蚀的本质是发生了氧化反应,故B正确;
C、与原电池的正极相连作阳极被腐蚀,则将钢闸门与直流电源的正极相连,不能防止被腐蚀,故C错误;
D、形成原电池时活泼性强的被腐蚀,在铁管上镀锌,锌被腐蚀,铁被保护,可防止其被腐蚀,故D正确.
故选C.
B、金属被腐蚀失电子被氧化,则金属被腐蚀的本质是发生了氧化反应,故B正确;
C、与原电池的正极相连作阳极被腐蚀,则将钢闸门与直流电源的正极相连,不能防止被腐蚀,故C错误;
D、形成原电池时活泼性强的被腐蚀,在铁管上镀锌,锌被腐蚀,铁被保护,可防止其被腐蚀,故D正确.
故选C.
点评:本题考查了金属的腐蚀与防护,防止金属腐蚀的方法有:牺牲阳极的阴极保护法、外加电流的阴极保护法、制成合金等,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图.关于A的下列说法中,正确的是( )
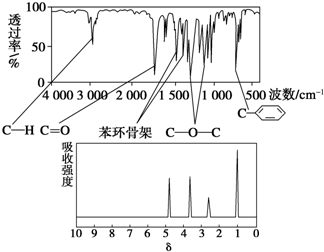

| A、与A属于同类化合物的同分异构体只有2种 |
| B、A在一定条件下可与4 mol H2发生加成反应 |
| C、A分子属于酯类化合物,在一定条件下不能发生水解反应 |
| D、符合题中A分子结构特征的有机物只有1种 |
在下列五种物质的组合中,既能跟氢氧化钠溶液反应,又能跟盐酸反应的化合物是( )
①Al ②Al(OH)3 ③Al2O3 ④Na2CO3 ⑤NaHCO3.
①Al ②Al(OH)3 ③Al2O3 ④Na2CO3 ⑤NaHCO3.
| A、①②③⑤ | B、①③④⑤ |
| C、②③⑤ | D、②④⑤ |
下列废弃物,可直接回收利用的是( )
| A、易拉罐 | B、可充电电池 |
| C、玻璃白酒瓶 | D、医用点滴管 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、使甲基橙变红的溶液:K+、Na+、SO42-、CO32- |
| B、pH=7的溶液中:Fe3+、K+、SO42-、Br- |
| C、c(H+)/c (OH-)═104的溶液:K+、Ba2+、NO3-、Cl- |
| D、水电离出的c(H+)═1.0×10-13 mol?L-1的溶液中:SO42-、K+、Cl-、Fe3+ |
 已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,下列说法不正确的是( )
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,下列说法不正确的是( )| A、该反应原理可用于设计氢氧燃料电池 | ||
| B、破坏1 mol H-O 键需要的能量是463.4 kJ | ||
C、H2O(g)=H2(g)+
| ||
| D、H2(g) 中的H-H 键比 H2O(g) 中的H-O 键牢固 |
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G-→Q+NaCl
②Q+H2O
X+H2
③Y+NaOH-→G+Q+H2O
④Z+NaOH-→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
①G-→Q+NaCl
②Q+H2O
| ||
③Y+NaOH-→G+Q+H2O
④Z+NaOH-→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
| A、G、Y、Q、Z、X |
| B、X、Z、Q、G、Y |
| C、X、Z、Q、Y、G |
| D、G、Q、Y、Z、X |