题目内容
14.氨气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O.则电解质溶液为KOH,则负极反应式为2NH3+6OH--6e-=N2+6H2O.分析 该燃料电池中负极上氨气失电子和氢氧根离子反应生成氮气和水.
解答 解:该燃料电池中负极上氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3+6OH--6e-=N2+6H2O,故答案为:2NH3+6OH--6e-=N2+6H2O.
点评 本题考查电极反应式的书写,为高频考点,明确各个电极上发生的反应是解本题关键,注意结合电解质溶液酸碱性书写电极反应式,题目难度不大.

练习册系列答案
相关题目
4.以CH3CH2CH2Cl为原料制取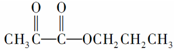 ,最简便的流程需要下列反应的顺序是
,最简便的流程需要下列反应的顺序是
a:氧化 b:还原 c:取代 d:加成 e:消去 f:中和 g:加聚 h:酯化( )
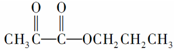 ,最简便的流程需要下列反应的顺序是
,最简便的流程需要下列反应的顺序是a:氧化 b:还原 c:取代 d:加成 e:消去 f:中和 g:加聚 h:酯化( )
| A. | b d f g h | B. | e a d c h | C. | b a e c h | D. | e d c a h |
2.下列不能使碘化钾淀粉试纸变蓝的物质是( )
| A. | 溴水 | B. | 溴化钠 | C. | 氯水 | D. | 碘水 |
9.已知三种有机物存在如下转化关系:
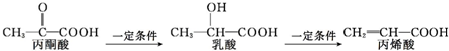
下列叙述错误的是( )

下列叙述错误的是( )
| A. | 三种有机物中都存在2种官能团 | |
| B. | 乳酸和丙烯酸都能使高锰酸钾酸性溶液褪色 | |
| C. | 1 mol乳酸最多能与2 mol Na发生反应 | |
| D. | 三种有机物均能发生聚合反应生成高分子化合物 |
6.下列溶液中可以盛放在玻璃瓶中,但不能用磨口玻璃塞的是( )
| A. | 硅酸钠溶液 | B. | 氢氟酸 | C. | 蔗糖溶液 | D. | 氯化钠溶液 |
4.下列关于Cl2和Cl-的叙述中,正确的是( )
| A. | 都有颜色 | B. | 都有毒性 | ||
| C. | 化学性质相似 | D. | 在一定条件下可以相互转化 |
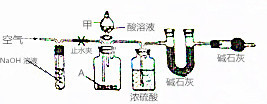 碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下: