题目内容
13.下列反应的离子方程式,正确的是( )| A. | 碳酸钙与硝酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | 将氨气通入盐酸中:NH3+HCl═NH4++Cl- | |
| D. | 氢氧化钡溶液中滴加稀硫酸:OH-+H+═H2O |
分析 A.碳酸钙为难溶物,离子方程式中应该保留化学式;
B.铁与稀硫酸反应生成硫酸亚铁和氢气;
C.氯化氢为强电解质,离子方程式中应该拆开;
D.氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水.
解答 解:A.碳酸钙与稀硝酸反应生成硝酸钙、二氧化碳气体和水,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为:Fe+2H+═Fe2++H2↑,故B正确;
C.将氨气通入盐酸中,HCl应该拆开,正确的离子方程式为:NH3+H+═NH4+,故C错误;
D.氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选B.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
4.欲将蛋白质从水中析出而又不改变它的性质,可加入( )
| A. | 饱和Na2SO4溶液 | B. | 浓硫酸 | C. | 酒精 | D. | CuSO4溶液 |
8.据最新报道,科学家发现了如下反应:O2+PtF6═O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt的化合价为+5,对于此反应,下列说法正确的是( )
| A. | O2 是氧化剂,PtF6 是还原剂 | |
| B. | O2(PtF6)中氧元素的化合价为+1 | |
| C. | O2(PtF6)中不存在共价键 | |
| D. | 每生成1mol O2(PtF6)则转移1mol电子 |
5.下列各组物质中,物质之间不可能实现如转化的是:( )X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z
| X | Y | Z | M | |
| A | N2 | NO | NO2 | O2 |
| B | Cl2 | FeCl3 | FeCl2 | Fe |
| C | Al2O3 | NaAlO2 | Al(OH)3 | NaOH |
| D | S | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
2. Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
(1)Fe元素价电子层的电子排布式为3d64s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是具有孤对电子;
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是sp;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体;
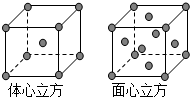
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为2:1.
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Fe元素价电子层的电子排布式为3d64s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是具有孤对电子;
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是sp;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体;
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为2:1.
3.下列离子方程式错误的是( )
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铁铜原电池(稀硫酸做电解质)放电时的负极反应:Fe-3e-═Fe3+ |
 、⑤ClCH=CHCl、
、⑤ClCH=CHCl、 ⑦
⑦ ⑧
⑧ ⑨1,3,5-庚三烯
⑨1,3,5-庚三烯 .
. 中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在.⑨1,3,5-庚三烯的众多链烃同分异构体中:含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的5种.含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是
中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在.⑨1,3,5-庚三烯的众多链烃同分异构体中:含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的5种.含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是 .
.