题目内容
3.元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是( )| A. | 11和16 | B. | 6和8 | C. | 12和17 | D. | 20和8 |
分析 活泼金属和活泼非金属之间易形成离子键,非金属元素之间易形成共价键(铵盐除外),含有离子键的化合物是离子化合物,XY2型离子化合物中X显+2价,Y显-1价,以此来解答.
解答 解:A.分别为Na、S,可形成Na2S离子化合物,故A不选;
B.分别为C、O,可形成共价化合物,故B不选;
C.分别为Mg、Cl,可形成MgCl2的离子化合物,为XY2的离子化合物,故C选;
D.分别为Ca、O,可形成CaO的离子化合物,为XY的离子化合物,故D不选;
故选C.
点评 本题考查原子序数及离子化合物,为高频考点,把握原子序数推断元素及化学键的形成等为解答的关键,侧重分析与应用能力的考查,注意化合物的类型,题目难度不大.

练习册系列答案
相关题目
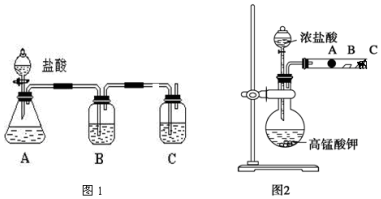
13.取一定质量的铜片和一定体积的浓硫酸放在烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,若要使铜片继续溶解可向烧瓶中加入( )
| A. | 稀H2SO4 | B. | 稀盐酸 | C. | K2SO4固体 | D. | KNO3固体 |
14. 已知某化学反应A2(g)+2B2(g)═2AB2(g)(A2、B2、AB2的结构式分别为 A═A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2(g)+2B2(g)═2AB2(g)(A2、B2、AB2的结构式分别为 A═A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是( )
 已知某化学反应A2(g)+2B2(g)═2AB2(g)(A2、B2、AB2的结构式分别为 A═A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2(g)+2B2(g)═2AB2(g)(A2、B2、AB2的结构式分别为 A═A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热或点燃条件 | |
| B. | 该反应若生成2molAB2(g)则放出的热量为 (E1-E2) kJ | |
| C. | 该反应断开化学键消耗的总能量大于形成化学键释放的总能量 | |
| D. | 生成2 mol B-A键放出E2 kJ能量 |
15.下列描述中正确的是( )
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SiF4和SO32-的中心原子均为sp2杂化 | |
| D. | SF6中有6对相同的成键电子对 |
8.下列说法不正确的是( )
| A. | 烷烃的同系物可用通式CnH2n+2表示 | |
| B. | 同系物的化学性质相似 | |
| C. | 同系物的物理性质相同 | |
| D. | 同分异构体的化学性质一定不相似 |
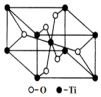 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4: .
.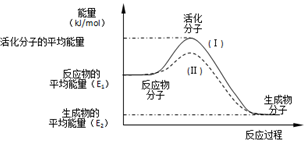 在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.
在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.