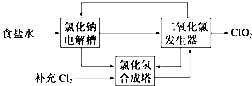
题目内容
下列关于第②步和第③步的说法,正确的是( )
| A、加入H2O2的主要作用是将溶液中的Fe2+氧化为Fe3+ |
| B、CuSO4?5H2O和Al2(SO4)3?18H2O均属于混合物 |
| C、实验室中过滤时可直接将滤液倒入有滤纸的漏斗中 |
| D、高锰酸钾溶液也可以氧化Fe2+,所以第②步中可以用酸性高锰酸钾溶液代替H2O2 |
考点:物质分离、提纯的实验方案设计
专题:实验设计题
分析:稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,而Au、Pt不反应,所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+、Fe3+,第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,经蒸发结晶可得到CuSO4?5H2O晶体,滤渣2的成分为氢氧化铁和氢氧化铝,在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,
A.过氧化氢具有强氧化性,结合铁离子易水解的性质判断;
B.根据纯净物、混合物的定义判断;
C.过滤时注意防止浊液外流;
D.除杂时注意防止引入新杂质.
A.过氧化氢具有强氧化性,结合铁离子易水解的性质判断;
B.根据纯净物、混合物的定义判断;
C.过滤时注意防止浊液外流;
D.除杂时注意防止引入新杂质.
解答:
解:稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,而Au、Pt不反应,所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+、Fe3+,第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,经蒸发结晶可得到CuSO4?5H2O晶体,滤渣2的成分为氢氧化铁和氢氧化铝,在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,
A.由于滤液中可能含有亚铁离子,而亚铁离子的存在会干扰后面物质的制备,因此加入过氧化氢的目的是将溶液中的亚铁离子氧化生成铁离子,通过调节pH形成沉淀而除去,故A正确;
B.由不同物质形成的是混合物,CuSO4?5H2O和Al2(SO4)3?18H2O都是纯净物,故B错误;
C.实验室过滤时应将滤液沿玻璃棒倒入有滤纸的烧杯中,故C错误;
D.高锰酸钾氧化亚铁离子时会引入杂质离子,不能代替双氧水,故D错误.
故选A.
A.由于滤液中可能含有亚铁离子,而亚铁离子的存在会干扰后面物质的制备,因此加入过氧化氢的目的是将溶液中的亚铁离子氧化生成铁离子,通过调节pH形成沉淀而除去,故A正确;
B.由不同物质形成的是混合物,CuSO4?5H2O和Al2(SO4)3?18H2O都是纯净物,故B错误;
C.实验室过滤时应将滤液沿玻璃棒倒入有滤纸的烧杯中,故C错误;
D.高锰酸钾氧化亚铁离子时会引入杂质离子,不能代替双氧水,故D错误.
故选A.
点评:本题考查物质的分离、提纯,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握实验的操作原理和物质的性质的异同,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于浓H2SO4的叙述中,错误的是( )
| A、常温下可使某些金属钝化 |
| B、具有脱水性,故能作干燥剂 |
| C、加热条件下可与木炭反应,其氧化产物为CO2 |
| D、溶于水放出大量的热,稀释的时候应将浓硫酸缓缓加入水中并不断搅拌 |
下列有机物命名实际上不可能存在的是( )
| A、2,2-二甲基丁烷 |
| B、3-甲基-2-丁烯 |
| C、4-甲基-1-戊炔 |
| D、1,3-二甲苯 |
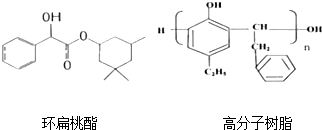
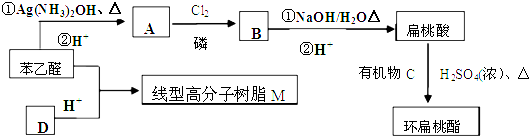
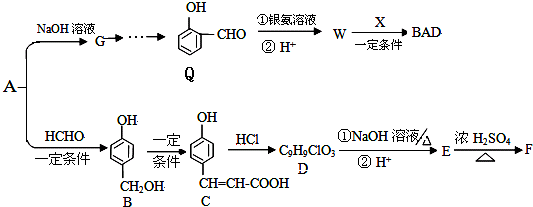
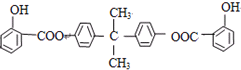
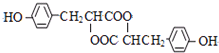
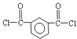 )发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式
)发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式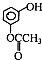
 硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.
硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.