题目内容
1.已知:①FeS不溶解于水;②实验室制取H2S、SO2气体的原理是:FeS+H2SO4=FeSO4+H2S↑,Na2SO3+H2SO4=Na2SO4+H2O+SO2;③硫化氢与二氧化硫气体相遇会发生反应:2H2S+SO2=3S↓+2H2O.根据图中A~D的实验装置和试剂进行实验,回答下列问题:
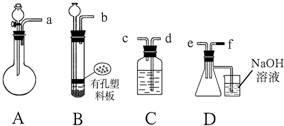
(1)装置A是由双孔塞、玻璃导管及分液漏斗和圆底烧瓶组装起来的.?
(2)组装一套制取SO2气体的装置,并证明SO2既有氧化性、又有还原性和漂白性.?①按实验装置连接顺序,把a→f各导管口连接起 来,正确的顺序有B.
A.befcda B.adcefb C.acdfeb D.acdefb
②若C装置中的溶液为酸性KMnO4溶液或溴水、碘水等,反应后该溶液变为无色,说明SO2具有还原性;?③若C装置中的溶液为品红溶液,反应后该溶液变为无色,说明SO2具有漂白性;
④当D中产生有淡黄色固体析出现象时,说明SO2具有氧化性;
(3)D装置烧杯中NaOH溶液的作用吸收过量的SO2或H2S,防止污染空气.
分析 (1)根据装置图可知A中仪器名称;
(2)①先判断硫化氢、二氧化硫的发生装置分别为装置B、装置A,然后按照检验二氧化硫的还原性(装置C)、氧化性(装置D),最后为尾气吸收装置,据此进行连接装置;
②溴水与二氧化硫反应生成盐酸和硫酸,反应后橙色溶液褪色,说明二氧化硫具有还原性;
③二氧化硫能使品红褪色,说明SO2具有漂白性;
④装置D中硫化氢与二氧化硫发生反应生成淡黄色的单质硫;
(3)二氧化硫和硫化氢都有毒,容易造成大气污染,需要进行尾气吸收.
解答 解:(1)根据装置图可知A中仪器有分液漏斗和圆底烧瓶,
故答案为:分液漏斗和圆底烧瓶;
(2)①FeS不溶解于水,而Na2SO3可溶于水,所以制取H2S的装置用B,而制SO2的装置为A;为了证明SO2的氧化性,应该在D装置的锥形瓶中混合两气体;为了证明其还原性,可以C试剂瓶中注放氧化剂,例如酸性KMnO4溶液或溴水等;很明显D装置中的碱溶液起到尾气吸收的作用,所以装置连接顺序为adcefb,
故选B;
②酸性KMnO4溶液或溴水、碘水等与二氧化硫反应生成盐酸和硫酸,反应后橙色溶液褪色,说明二氧化硫具有还原性,
故答案为:还原;
③二氧化硫能使品红褪色,说明SO2具有漂白性,所以C装置中的溶液为品红溶液,故答案为:品红溶液;
④装置D的作用是证明二氧化硫具有氧化性,二氧化硫能够与硫化氢发生氧化还原反应生成单质硫,装置D内壁有淡黄色固体析出,
故答案为:有淡黄色固体析出;
(3)硫化氢和二氧化硫都有毒,会污染大气,不能直接排放,需要使用尾气吸收装置,D装置烧杯中NaOH溶液的作用为吸收过量的SO2或H2S,防止污染空气,
故答案为:吸收过量的SO2或H2S,防止污染空气.
点评 本题考查含硫的化合物的相关性质及实验,题目难度中等,解题关键是明确实验目的、实验原理,有利于培养学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9m~10-7m之间 | |
| B. | 用平行光照射NaCl溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液与NaOH溶液混合,以制取Fe(OH)3胶体 | |
| D. | 除去Fe(OH)3胶体中的H+、Cl-,可用渗析的实验方法 |
| A. |  =KCl+3Cl2↑+3H2O =KCl+3Cl2↑+3H2O | |
| B. | H2S+H2SO4(浓)═S↓+SO2↑+2H2O | |
| C. | 2H2S+SO2═3S↓+2H2O中氧化剂与还原剂的物质的量之比是1:2 | |
| D. | 3NO2+H2O═2HNO3+NO中氧化剂与还原剂的物质的量之比是1:1 |
| A. | N2将完全转化为NH3 | |
| B. | N2、H2、和NH3的物质的量浓度相等 | |
| C. | N2、H2、和NH3的物质的量浓度不在变化 | |
| D. | 正反应和逆反应的速率都为零 |
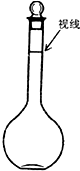 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
 ;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.