题目内容
14.已知C(固)+O2(气)=CO2(气)+393.5KJ,计算在相同条件下每燃烧1kg碳应放出多少热量?分析 C(固)+O2(气)=CO2(气)+393.5KJ表示12g碳单质完全燃烧生成二氧化碳会放出393.5KJ的热量,据此计算燃烧1kg碳应放出的热量.
解答 解:C(固)+O2(气)=CO2(气)+393.5KJ表示12g碳单质完全燃烧生成二氧化碳会放出393.5KJ的热量,在相同条件下每燃烧1kg碳应放出热量为:$\frac{393.5×1000}{12}$kJ=32791.7kJ,
答:在相同条件下每燃烧1kg碳应放出32791.7kJ热量.
点评 本题考查学生呢个热化学方程式的计算知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 18g水含有的原子数为NA | |
| B. | 4g金属钙变成钙离子时失去的电子数为0.1NA | |
| C. | 1molO2的质量等于1mol氧原子的质量 | |
| D. | 24gO2和24gO3所含的原子数目相等 |
5.甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小
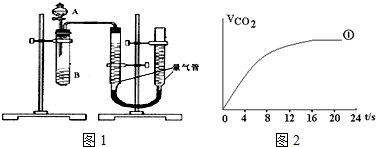
某同学进行实验,实验装置如图1.其中A、B的成分见表
(1)该实验的目的是探究草酸浓度和催化剂对化学反应速率的影响.
(2)实验开始前需要检查气密性.分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)完成该实验还需要秒表(填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平.
(4)请在图2中,画出实验②、③中CO2体积随时间变化的预期结果示意图.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
(5)X=5,4号实验中始终没有观察到溶液褪色,你认为可能的原因是KMnO4过量.
(6)2号反应中,H2C2O4的反应速率为0.00625mol/(L•s).
(7)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,
溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
结合实验目的与表中数据,你得出的结论是温度不是反应速率突然加快的原因.
(8)从影响化学反应速率的因素看,你的猜想还可能是反应产物的影响.
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小
某同学进行实验,实验装置如图1.其中A、B的成分见表
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③ | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液和少量MnSO4 |
(2)实验开始前需要检查气密性.分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)完成该实验还需要秒表(填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平.
(4)请在图2中,画出实验②、③中CO2体积随时间变化的预期结果示意图.

乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
(6)2号反应中,H2C2O4的反应速率为0.00625mol/(L•s).
(7)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,
溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
(8)从影响化学反应速率的因素看,你的猜想还可能是反应产物的影响.
6. 正丁醛是一种化工原料.
正丁醛是一种化工原料.
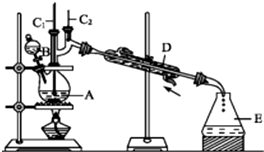
某实验小组利用如下装置合成正丁醛.
发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸气出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,容易发生迸溅.
(2)加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(3)上述装置图中,B仪器的名称是滴液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是C(填正确答案标号).
A.润湿B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”).
(6)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
 正丁醛是一种化工原料.
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸气出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,容易发生迸溅.
(2)加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(3)上述装置图中,B仪器的名称是滴液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是C(填正确答案标号).
A.润湿B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”).
(6)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
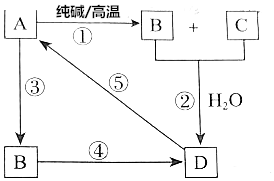 已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.
已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.