题目内容
11.写出一种重铬酸盐热分解制备N2的化学反应方程式,并配平.分析 根据质量守恒,制备氮气的物质中一定要有氮元素,题中还要求是分解反应产生,根据铵盐受热易分解,从而来确定反应物为重铬酸铵,即(NH4)2Cr2O7,其中氮元素化合价升高得到氮气,铬元素化合价降低得到三氧化二铬,再根据氧化还原反应化合价的升降配平方程式.
解答 解:根据质量守恒,制备氮气的物质中一定要有氮元素,题中还要求是分解反应产生,根据铵盐受热易分解,从而来确定反应物为重铬酸铵,其中氮元素化合价升高得到氮气,铬元素化合价降低得到三氧化二铬,反应方程式式为:(NH4)2Cr2O7$\frac{\underline{\;加热\;}}{\;}$Cr2O3+N2↑+4H2O,
故答案为:(NH4)2Cr2O7$\frac{\underline{\;加热\;}}{\;}$Cr2O3+N2↑+4H2O.
点评 本题考查了质量守恒,氧化还原反应方程式的书写与配平的方法,题中铵盐的性质考查了学生知识的迁移能力,铵盐受热分解源于教材,又高于教材,是很好的一道考查学生能力的题目.

练习册系列答案
相关题目
1.既可用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有少量乙烯的操作方法是( )
| A. | 通过盛水的洗气瓶 | B. | 通过装有过量溴水的洗气瓶 | ||
| C. | 和过量H2混合 | D. | 通过酸性KMnO4溶液 |
2.已知R-CH2OH$\stackrel{酸性KMnO_{4}溶液}{→}$R-COOH(R为H原子或烃基),A(C6H14O)、B、C三种有机物之间具有如图所示的转化关系: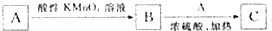 ,若A、B的碳骨架相同,则C的结构最多有
,若A、B的碳骨架相同,则C的结构最多有
( )
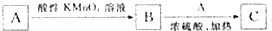 ,若A、B的碳骨架相同,则C的结构最多有
,若A、B的碳骨架相同,则C的结构最多有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
19.已知常温下Ksp[Cu(OH)2]=2.2×10-20mol3•L-3、Ksp[Al(OH)3]=1.3×10-33mol4•L-4、Ksp[Fe(OH)3]=4.0×10-38mol4•L-4.某1L溶液中含有Cu2+、Al3+、Fe3+、H+,浓度均为1.0×10-2mol•L-1,向该溶液中加入少量的NaOH固体,测得溶液的pH=3,溶液的体积变化忽略不计.下列有关叙述正确的是( )
| A. | 有Al(OH)3、Fe(OH)3沉淀析出 | |
| B. | 所得混合液中:$\frac{c(A{l}^{3+})}{c(F{e}^{3+})}$=3.25×104 | |
| C. | 所得混合液中相关微粒的浓度大小:c(Cu2+)=c(Al3+)>c(Fe3+)>c(H+) | |
| D. | 若向原溶液中逐滴加入NaOH溶液,最后析出的是Cu(OH)2沉淀 |
6.下列变化需要加入氧化剂才能实现的是( )
| A. | NH${\;}_{4}^{+}$→NH3 | B. | S→S2- | C. | HCl→Cl2 | D. | CO32-→CO2 |
11. 高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项).
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
2MnO4-+5C2O42-+16H+--2Mn2++CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
请分析高锰酸钾溶液褪色时间变化的原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)大催化效果更好.
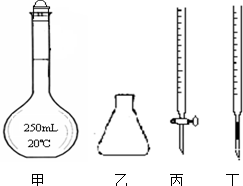
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
①高锰酸钾溶液应装在丙(填图中的仪器编号).
②若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是AC.
A.未润洗盛放KMnO4的滴定管 B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线 D.锥形瓶用水洗之后未用待测液润洗
③该滴定达到终点的标志为逐滴滴入高锰酸钾溶液,当滴入最后一滴高锰酸钾溶液时,溶液由无色变为紫红色,且半分钟内不褪色,最终消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.0200mol/L(取4位有效数字).
 高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项).
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
2MnO4-+5C2O42-+16H+--2Mn2++CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
| 滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
①高锰酸钾溶液应装在丙(填图中的仪器编号).
②若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是AC.
A.未润洗盛放KMnO4的滴定管 B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线 D.锥形瓶用水洗之后未用待测液润洗
③该滴定达到终点的标志为逐滴滴入高锰酸钾溶液,当滴入最后一滴高锰酸钾溶液时,溶液由无色变为紫红色,且半分钟内不褪色,最终消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.0200mol/L(取4位有效数字).
9.在一定温度下,在恒压的密闭容器中进行的可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | 混合气体密度保持不变 | |
| B. | 单位时间内生成n mol A,同时生成3n mol B | |
| C. | 混合气体的压强保持不变 | |
| D. | C生成的速率与A分解的速率相等 |
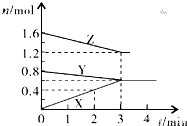 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随间变化的曲线如图所示.由图中数据分析
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随间变化的曲线如图所示.由图中数据分析