题目内容
工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
已知:CrO
Cr2O
Cr3+
Cr(OH)3↓
(1)步骤①中存在平衡:2CrO42-(黄色)+2H+?Cr2O42-(橙色)+H2O
(2)步骤③生成的Cr(OH)3,在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5mol?L-1 时可视作该离子不存下列有关说法中,正确的是( )
已知:CrO
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
(1)步骤①中存在平衡:2CrO42-(黄色)+2H+?Cr2O42-(橙色)+H2O
(2)步骤③生成的Cr(OH)3,在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5mol?L-1 时可视作该离子不存下列有关说法中,正确的是( )
| A、步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 |
| B、步骤①中当2v(CrO42-)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O达到平衡状态 |
| C、步骤②中,若要还原1mol Cr2O72-离子,需要12mol (NH4)2Fe(SO4)2?6H2O |
| D、步骤③中,当将溶液的pH调节至6 时,则可认为废水中的铬已除尽 |
考点:物质分离和提纯的方法和基本操作综合应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验设计题
分析:A.步骤①中加酸,氢离子浓度增大,平衡正向移动;
B.2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,结合Ksp计算.
B.2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,结合Ksp计算.
解答:
解:A.步骤①中加酸,氢离子浓度增大,平衡正向移动,则CrO42-离子浓度减小,故A错误;
B.当2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等,则该反应不能达到平衡,故B错误;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3,则由电子守恒可知需要6 mol(NH4)2Fe(SO4)2?6H2O,故C错误;
D.步骤③中,当将溶液的pH 调节至6 时,c(OH-)=10-8mol/L,由Ksp可知,c(Cr3+)=
=10-8mol/L,则可认为废水中的铬元素已经除尽,故D正确;
故选D.
B.当2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等,则该反应不能达到平衡,故B错误;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3,则由电子守恒可知需要6 mol(NH4)2Fe(SO4)2?6H2O,故C错误;
D.步骤③中,当将溶液的pH 调节至6 时,c(OH-)=10-8mol/L,由Ksp可知,c(Cr3+)=
| 10-32 |
| (10-8)3 |
故选D.
点评:本题考查化学平衡的影响因素,涉及反应速率、平衡移动、转移电子计算、溶解度计算等,注重学生知识迁移应用能力的考查,题目难度中等.

练习册系列答案
相关题目
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A、氢氧化钠与盐酸;氢氧化钠与硫酸 |
| B、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| C、Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 |
| D、石灰石与硝酸反应;石灰石与盐酸 |
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-
Cr2O72-
Cr3+
Cr(OH)3↓
己知转化过程中反应为:2CrO42-(aq)+2H+(aq)?Cr2O72-(aq)+H2O(l).转化后所得溶液中铬元素含量为28.6g/L,CrO42-有
转化为Cr2O72-.下列说法不正确的是( )
CrO42-
| H+ |
| 转换 |
| Fe2+ |
| 还原 |
| OH- |
| 沉淀 |
己知转化过程中反应为:2CrO42-(aq)+2H+(aq)?Cr2O72-(aq)+H2O(l).转化后所得溶液中铬元素含量为28.6g/L,CrO42-有
| 10 |
| 11 |
| A、若用绿矾(FeSO4?7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| B、溶液颜色保持不变,说明上述可逆反应达到达平衡状态 |
| C、常温下转换反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D、常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
人体内含有多种元素,其中许多元素都是人体所需的.但有些元素尚未证实其生理功能,相反,在食品中它们含量稍高会引起中毒反应,食品卫生法对它们的最高标准有极严格的规定.这些元素是( )
①Na ②Mg ③As ④Cd ⑤Ca ⑥Zn ⑦Hg ⑧Pb ⑨Cu ⑩K中的.
①Na ②Mg ③As ④Cd ⑤Ca ⑥Zn ⑦Hg ⑧Pb ⑨Cu ⑩K中的.
| A、⑥⑦⑧⑨ | B、②④⑥⑧ |
| C、③④⑦⑧ | D、②④⑥⑦⑧ |
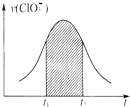 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )| A、反应开始时速率增大可能是c(H+)所致 |
| B、纵座标为V(H+)的V-t曲线与图中曲线完全重合 |
| C、后期反应速率下降的主要原因是反应物浓度减小 |
| D、图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加 |
下列叙述中正确的是( )
| A、常温常压下,28 g氮气所含的原子数为2NA |
| B、1 mol氯化氢约含有6.02×1023个粒子 |
| C、22.4 L甲烷(CH4)所含的原子数为5 NA |
| D、2.4 g镁原子变成离子时,失去的电子数为0.3 NA |
以下说法正确的是( )
| A、电解饱和食盐水,阳极反应式一定为:2Cl--2e-=Cl2↑ |
| B、无论是原电池还是电解池中,电子均不能通过电解质溶液 |
| C、电解精炼铜时,粗铜作阴极 |
| D、为保护地下钢管不受腐蚀,可使它与铜板相连 |
以1一氯丙烷为主要原料,制取1,2-丙二醇时,需要经过的各反应分别为( )
| A、加成-消去-取代 |
| B、消去-加成-取代 |
| C、取代-消去-加成 |
| D、取代-加成-消去 |