题目内容
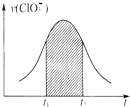 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )| A、反应开始时速率增大可能是c(H+)所致 |
| B、纵座标为V(H+)的V-t曲线与图中曲线完全重合 |
| C、后期反应速率下降的主要原因是反应物浓度减小 |
| D、图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加 |
考点:化学反应速率与化学平衡图象的综合应用
专题:化学反应速率专题
分析:A.由题目信息可知反应的速率随c(H+)的增大而加快;
B.先根据电子得失守恒和原子守恒配平方程式,然后根据速率之比等于化学计量数之比;
C.根据随着反应的进行,反应物的浓度减少,反应速率减小;
D.先根据电子得失守恒和原子守恒配平方程式,然后根据改变的物质的量之比等于化学计量数之比.
B.先根据电子得失守恒和原子守恒配平方程式,然后根据速率之比等于化学计量数之比;
C.根据随着反应的进行,反应物的浓度减少,反应速率减小;
D.先根据电子得失守恒和原子守恒配平方程式,然后根据改变的物质的量之比等于化学计量数之比.
解答:
解:A.由方程式:ClO3-+HSO3--SO42-+Cl-+H+可知:反应开始时随着反应的进行,c(H+)不断增大,反应的速率加快由题目信息可知反应的速率随c(H+)的增大而加快,故A正确;
B.在反应中ClO3-+HSO3--SO42-+Cl-+H+,1molClO3-参加氧化还原反应得到6mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是6,则ClO3-的计量数是1,亚硫酸氢根离子的计量数是3,其它原子根据原子守恒来配平,所以该方程式为:ClO3-+3HSO3-=3SO42-+Cl-+3H+,v(ClO3-):v(H+)=1:3,纵坐标为v(H+)的v-t曲线与图中曲线不重合,故B错误;
C.随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率下降的主要原因是反应物浓度减小,故C正确;
D.在反应中ClO3-+HSO3--SO42-+Cl-+H+,1molClO3-参加氧化还原反应得到6mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是6,则ClO3-的计量数是1,亚硫酸氢根离子的计量数是3,其它原子根据原子守恒来配平,所以该方程式为:ClO3-+3HSO3-=3SO42-+Cl-+3H+,△n(Cl-):△n(ClO3-)=1:1,所以图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加,故D正确;
故选:B.
B.在反应中ClO3-+HSO3--SO42-+Cl-+H+,1molClO3-参加氧化还原反应得到6mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是6,则ClO3-的计量数是1,亚硫酸氢根离子的计量数是3,其它原子根据原子守恒来配平,所以该方程式为:ClO3-+3HSO3-=3SO42-+Cl-+3H+,v(ClO3-):v(H+)=1:3,纵坐标为v(H+)的v-t曲线与图中曲线不重合,故B错误;
C.随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率下降的主要原因是反应物浓度减小,故C正确;
D.在反应中ClO3-+HSO3--SO42-+Cl-+H+,1molClO3-参加氧化还原反应得到6mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是6,则ClO3-的计量数是1,亚硫酸氢根离子的计量数是3,其它原子根据原子守恒来配平,所以该方程式为:ClO3-+3HSO3-=3SO42-+Cl-+3H+,△n(Cl-):△n(ClO3-)=1:1,所以图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加,故D正确;
故选:B.
点评:本题主要考查了外界条件对化学反应速率的有关知识,难度不大,需要注意的是要抓住题目的信息是解答A选项的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关物质用途的描述不正确的是( )
| A、氯气是一种重要的化工原料,可用于农药的生产等 |
| B、钠钾合金可用于快中子反应堆作热交换剂 |
| C、碳酸钠在医疗上是治疗胃酸过多的一种药剂 |
| D、镁常用来制造信号弹和焰火 |
下列混合物中,能够用蒸馏的方法分离的是( )
| A、酒精和水 |
| B、汽油和水 |
| C、碘和氯化钠的水溶液 |
| D、泥沙和食盐 |
下列关于硝酸的叙述正确的是( )
| A、硝酸是无色、不挥发的液体 |
| B、稀硝酸的氧化性比浓硝酸强 |
| C、浓硝酸久置呈黄色 |
| D、浓硝酸和铁常温下不发生任何反应 |
下列实验能获得成功的是( )
| A、苯和浓溴水用铁作催化剂制溴苯 |
| B、氯乙烷中加入AgNO3溶液检验Cl- |
| C、CH4与Cl2在光照条件下制备纯净的CH3Cl |
| D、乙烯通入Br2的CCl4溶液中制备CH2Br-CH2Br |
工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
已知:CrO
Cr2O
Cr3+
Cr(OH)3↓
(1)步骤①中存在平衡:2CrO42-(黄色)+2H+?Cr2O42-(橙色)+H2O
(2)步骤③生成的Cr(OH)3,在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5mol?L-1 时可视作该离子不存下列有关说法中,正确的是( )
已知:CrO
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
(1)步骤①中存在平衡:2CrO42-(黄色)+2H+?Cr2O42-(橙色)+H2O
(2)步骤③生成的Cr(OH)3,在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5mol?L-1 时可视作该离子不存下列有关说法中,正确的是( )
| A、步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 |
| B、步骤①中当2v(CrO42-)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O达到平衡状态 |
| C、步骤②中,若要还原1mol Cr2O72-离子,需要12mol (NH4)2Fe(SO4)2?6H2O |
| D、步骤③中,当将溶液的pH调节至6 时,则可认为废水中的铬已除尽 |
当电解饱和盐水时,如果有0.1mol电子发生转移,在标准状况下产生气体的总体积是( )
| A、8.96L |
| B、4.48L |
| C、44.8L |
| D、2.24L |
