题目内容
20.写出下列反应的离子方程式:(1)铁粉与硫酸铜溶液的反应:Fe+Cu2+═Fe2++Cu
(2)碳酸钙与稀盐酸溶液的反应:CaCO3+2H+=CO2↑+H2O+Ca2+
(3)氢氧化钡溶液与硫酸溶液的反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O.
分析 (1)铁粉与硫酸铜溶液的反应生成硫酸亚铁和铜;
(2)碳酸钙与稀盐酸溶液的反应生成氯化钙和水、二氧化碳;
(3)二者反应生成硫酸钡沉淀和水.
解答 解:(1)铁粉与硫酸铜溶液的反应生成硫酸亚铁和铜,方程式:Fe+Cu2+═Fe2++Cu,故答案为:Fe+Cu2+═Fe2++Cu;
(2)碳酸钙与稀盐酸溶液的反应生成氯化钙和水、二氧化碳,方程式:CaCO3+2H+=CO2↑+H2O+Ca2+,故答案为:CaCO3+2H+=CO2↑+H2O+Ca2+;
(3)二者反应生成硫酸钡沉淀和水,方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意离子反应的书写方法即可解答,题目难度不大.

练习册系列答案
相关题目
10.关于氧化还原反应,下列说法正确的是( )
| A. | 分解反应不一定是氧化还原反应 | |
| B. | 非金属单质在化学反应中只做氧化剂 | |
| C. | 某物质被还原时,该元素一定从化合态变为游离态 | |
| D. | 氧化剂被氧化,还原剂被还原 |
11.下列气体中能使湿润的红色石蕊试纸变蓝色的是( )
| A. | NH3 | B. | SO2 | C. | NO2 | D. | Cl2 |
15.下列关于2molNH3的叙述中,正确的是( )
| A. | 质量为34g | B. | 体积为44.8L | ||
| C. | 原子数为2×6.02×1023 | D. | 摩尔质量为17 |
5.下列反应既是氧化还原反应,又是吸热反应的是( )
| A. | 镁片与稀硫酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |
9.X、Y为短周期元素,X的最高价氧化物对应的水化物是难溶碱.Y元素的原子次外层电子数为2;它的最高价氧化物对应的水化物为强酸;X的单质在Y中燃烧生成的化合物的电子数为( )
| A. | 19 | B. | 30 | C. | 45 | D. | 50 |
11.下列选项中所涉及到的两个量一定不相等的是( )
| A. | 足量的钠在等物质的量的Cl2和O2中分别燃烧转移电子数 | |
| B. | 等物质的量的KO2与CaO2分别与水反应生成O2的体积(相同条件下) | |
| C. | 100mL 1mol/L HNO3分别与1.4g Fe、2.8gFe完全反应时生成 的NO物质的量 | |
| D. | 等浓度等体积的盐酸、NaOH溶液分别与一定量Al反应生成等质量气体时转移的电子数 |
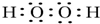 .W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)