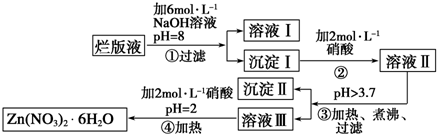
题目内容
12.现有两份质量比不同的铝粉与过氧化钠的混合物样品,分别加入稀盐酸中,混合物完全溶解.(1)在第一份样品反应所得的混合液中,若c(Al3+):c(H+):c(Cl-)=1:2:8,则原固体混合物中,铝元素与氧元素的质量比为9:16(最简整数比).
(2)在第二份样品的反应中,若转移电子总数为a mol,收集到混合气体的体积为b L(标准状况),则a:b=2:22.4.
分析 (1)反应有HCl剩余,溶液为NaCl、HCl、AlCl3混合溶液,同一溶液中离子浓度之比等于物质的量之比,令n(Al3+)、n(H+)、n(Cl-)分别为1mol、2mol、8mol,根据电荷守恒计算n(Na+),再根据原子守恒计算n(Al)、n(Na2O2),结合守恒,再根据m=nM计算;
(2)反应收集的气体为氢气、氧气,令氢气、氧气的物质的量分别为xmol、ymol,根据转移电子与气体体积列方程计算解答.
解答 解:(1)反应有HCl剩余,溶液为NaCl、HCl、AlCl3混合溶液,同一溶液中离子浓度之比等于物质的量之比,令n(Al3+)、n(H+)、n(Cl-)分别为1mol、2mol、8mol,根据电荷守恒,可知n(Na+)=n(Cl-)-n(H+)-3n(Al3+)=8mol-2mol-1mol×3=3mol,结合守恒可知,原混合物中n(Al)=n(Al3+)=1mol,n(O原子)=n(Na+)=3mol,故m(Al):(O元素)=1mol×27g/mol:3mol×16g/mol=9:16,
故答案为:9:16;
(2)反应收集的气体为氢气、氧气,令氢气、氧气的物质的量分别为xmol、ymol,根据转移电子与气体体积可得:$\left\{\begin{array}{l}{x+y=\frac{b}{22.4}}\\{2x+2y=a}\end{array}\right.$,整理的a:b=2:22.4,
故答案为:22.4.
点评 本题考查混合物计算,清楚发生的反应是解题关键,利用终态物质进行解答,注意守恒思想的应用,侧重对解题方法技巧与学生思维能力的考查,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.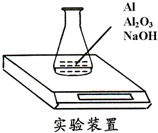 某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
(1)反应中产生的氢气质量为0.06g.
(2)求样品中Al的质量分数.(要求有计算过程)
 某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:| 读数次数 | 质量(g) | |
| 锥形瓶 + NaOH溶液 + 试样 | 第1次 | 188.30 |
| 第2次 | 188.28 | |
| 第3次 | 188.25 | |
| 第4次 | 188.24 | |
| 第5次 | 188.24 |
(2)求样品中Al的质量分数.(要求有计算过程)
7.氢气是人类理想的能源.已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则下列热化学方程式书写正确的是( )
| A. | 2H2+O2═2H2O△H=-142.9 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ/mol |
17.已知在一容器中用原电池实现反应:Fe+Cu2+═Fe2++Cu,有关说法不正确的是( )
| A. | 铁作负极 | |
| B. | 正极材料可以是石墨 | |
| C. | 电解质可以是CuSO4溶液 | |
| D. | 0.2mol电子通过电解质移动向正极被0.2molCu2+得到 |
4.有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极②B、C相连后,同时浸入稀H2SO4中,B极发生氧化反应 ③C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D,则四种金属的活动性顺序为( )
| A. | A>B>C>D | B. | C>A>B>D | C. | A>C>D>B | D. | B>D>C>A |
3.已知a、b两种脂肪烃的结构简式如图所示.下列说法中不正确的是( )
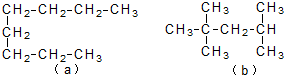
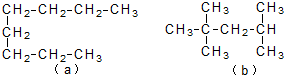
| A. | a和b都不能使酸性KMnO4溶液褪色 | |
| B. | a和b分子中的所有碳碳单键间的键角都相同 | |
| C. | a的沸点比b高 | |
| D. | b脱氢可以形成3种单烯烃分子 |