题目内容
15.下列关于2molNH3的叙述中,正确的是( )| A. | 质量为34g | B. | 体积为44.8L | ||
| C. | 原子数为2×6.02×1023 | D. | 摩尔质量为17 |
分析 A.根据m=nM计算出2mol氨气的质量;
B.没有指出在标准状况下,不能使用标准状况下的气体摩尔体积计算;
C.氨气分子中含有4个原子,2mol氨气分子中含有8mol原子;
D.摩尔质量的单位为g/mol,17为氨气的相对分子质量.
解答 解:A.2mol氨气的质量为:17g/mol×2mol=34g,故A正确;
B.标准状况下2mol氨气的体积为:22.4L/mol×2mol=44.8L,题中没有告诉在标准状况下,其体积不一定为44.8L,故B错误;
C.2mol氨气分子中含有8mol原子,含有的原子数为8×6.02×1023,故C错误;
D.氨气的摩尔质量为17g/mol,故D错误;
故选A.
点评 本题考查了物质的量的计算,题目难度不大,明确标准状况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量汉语摩尔质量、阿伏伽德罗常数之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
5.下列关于肥皂和合成洗涤剂的说法不正确的是( )
| A. | 肥皂和合成洗涤剂的结构相似,都含有憎水基和亲水基 | |
| B. | 肥皂不适用于硬水中洗涤,合成洗涤剂可以 | |
| C. | 合成洗涤剂难以被微生物分解,所以去污能力比肥皂好 | |
| D. | 肥皂的生产原料是油脂,成本高,合成洗涤剂的生产原料是石油副产品,成本较低 |
6.下列溶液中,滴加KSCN溶液颜色变红色的是( )
| A. | 氯化铁溶液 | B. | 氯化亚铁溶液 | C. | 氯化铜溶液 | D. | 硫酸铜溶液 |
3.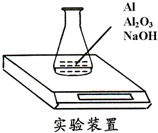 某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
(1)反应中产生的氢气质量为0.06g.
(2)求样品中Al的质量分数.(要求有计算过程)
 某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:| 读数次数 | 质量(g) | |
| 锥形瓶 + NaOH溶液 + 试样 | 第1次 | 188.30 |
| 第2次 | 188.28 | |
| 第3次 | 188.25 | |
| 第4次 | 188.24 | |
| 第5次 | 188.24 |
(2)求样品中Al的质量分数.(要求有计算过程)
10.胶体区别于其他分散系的本质特征是( )
| A. | 胶体是澄清透明的 | B. | 胶体能产生丁达尔现象 | ||
| C. | 分散质粒子直径在1nm~100nm之间 | D. | 胶体在一定条件下能稳定存在 |
7.氢气是人类理想的能源.已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则下列热化学方程式书写正确的是( )
| A. | 2H2+O2═2H2O△H=-142.9 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ/mol |
4.有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极②B、C相连后,同时浸入稀H2SO4中,B极发生氧化反应 ③C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D,则四种金属的活动性顺序为( )
| A. | A>B>C>D | B. | C>A>B>D | C. | A>C>D>B | D. | B>D>C>A |
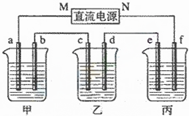 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.85%的NaCl溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.85%的NaCl溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.