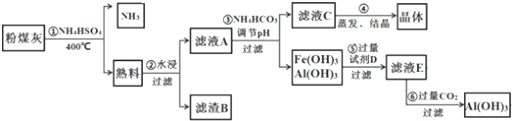
题目内容
5.下列反应既是氧化还原反应,又是吸热反应的是( )| A. | 镁片与稀硫酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |
分析 存在元素的化合价变化的反应为氧化还原反应,常见的吸热反应有:Ba(OH)2•8H2O与NH4Cl反应、大多数的分解反应、C(或氢气)参加的氧化还原反应等,以此来解答.
解答 解:A.Mg与稀H2SO4反应,有化合价的变化属于氧化还原反应,但属于放热反应,故A错误;
B.Ba(OH)2•8H2O与NH4Cl的反应为吸热反应,但不是氧化还原反应,故B错误;
C.灼热的炭与CO2反应,有化合价的变化属于氧化还原反应,且属于吸热反应,故C正确;
D.甲烷在O2中的燃烧反应,有化合价的变化属于氧化还原反应,但属于放热反应,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,侧重反应类型判断的考查,注意化合价角度及归纳常见的吸热反应分析,题目难度不大.

练习册系列答案
相关题目
16.下列有关钠的叙述中正确的是( )
| A. | 钠在自然界中不存在游离态 | B. | 钠是一种白色固体 | ||
| C. | 钠可以保存在煤油中 | D. | 钠着火时可以用水灭火 |
13.制取Fe(OH)3胶体的方法是( )
| A. | 将FeCl3固体放入水中搅拌 | |
| B. | 向FeCl3溶液中加入NaOH溶液 | |
| C. | 加热FeCl3溶液 | |
| D. | 向沸水中滴加饱和FeCl3溶液,并加热至红褐色 |
10.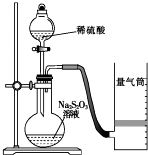 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法(写一种):测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如表.
(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
(4)该实验进行的目的是探究反应物浓度(Na2S2O3)对化学反应速率的影响,淀粉溶液的作用是作为显色剂,检验I2的存在,表中Vx=4.0 mL,比较t1、t2、t3大小,试推测该实验结论:其他条件不变,反应物浓度越大,化学反应速率越大.
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法(写一种):测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如表.
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)该实验进行的目的是探究反应物浓度(Na2S2O3)对化学反应速率的影响,淀粉溶液的作用是作为显色剂,检验I2的存在,表中Vx=4.0 mL,比较t1、t2、t3大小,试推测该实验结论:其他条件不变,反应物浓度越大,化学反应速率越大.
17.已知在一容器中用原电池实现反应:Fe+Cu2+═Fe2++Cu,有关说法不正确的是( )
| A. | 铁作负极 | |
| B. | 正极材料可以是石墨 | |
| C. | 电解质可以是CuSO4溶液 | |
| D. | 0.2mol电子通过电解质移动向正极被0.2molCu2+得到 |
14.下列键线式所表示的有机物中,属于环烷烃的是( )
| A. |  | B. |  | C. |  | D. |  |