题目内容
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为 (填序号).A.9 B.13C.11~13之间D.9~11之间
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中:
c(Na+) c(CH3COO-) ( 填“>”、“=”或“<”).
(3)如果将HCl和CH3COONa 溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为
(4)常温下,若NaOH溶液中的c(OH-)与CH3COOH 溶液中的c(H+)相同,现将NaOH和CH3COOH的溶液分别稀释10倍,稀释后NaOH 和 CH3COOH溶液的pH分别用pH1和pH2表示.则pH1+pH2 14(“>”、“=”或“<”)
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中:
c(Na+)
(3)如果将HCl和CH3COONa 溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为
(4)常温下,若NaOH溶液中的c(OH-)与CH3COOH 溶液中的c(H+)相同,现将NaOH和CH3COOH的溶液分别稀释10倍,稀释后NaOH 和 CH3COOH溶液的pH分别用pH1和pH2表示.则pH1+pH2
考点:pH的简单计算,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的
;
(2)pH=3的醋酸,其浓度大于0.001mol/L,pH=11的氢氧化钠,其浓度等于0.001mol/L,等体积混合后,醋酸过量;
(3)HCl和CH3COONa溶液等浓度、等体积混合,反应生成醋酸醋酸和氯化钠,根据醋酸和氯化钠混合液中离子浓度大小进行分析;
(4)强碱每稀释10倍,PH下降1个单位,CH3COOH为弱酸,稀释醋酸的电离程度增大,每稀释10倍,稀释后的醋酸溶液的pH介于原pH和下降1个单位之间.
| 1 |
| 100 |
(2)pH=3的醋酸,其浓度大于0.001mol/L,pH=11的氢氧化钠,其浓度等于0.001mol/L,等体积混合后,醋酸过量;
(3)HCl和CH3COONa溶液等浓度、等体积混合,反应生成醋酸醋酸和氯化钠,根据醋酸和氯化钠混合液中离子浓度大小进行分析;
(4)强碱每稀释10倍,PH下降1个单位,CH3COOH为弱酸,稀释醋酸的电离程度增大,每稀释10倍,稀释后的醋酸溶液的pH介于原pH和下降1个单位之间.
解答:
解:(1)一水合氨为弱电解质,存在电离平衡,稀释后一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,所以将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的
,溶液的pH应该9-11之间,
故答案为:D;
(2)pH=3的醋酸,其浓度大于0.001mol/L,pH=11的氢氧化钠,其浓度等于0.001mol/L,等体积混合后,醋酸过量,为醋酸和醋酸钠的混合溶液,则溶液显酸性,根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),c(H+)>c(OH-),则c(Na+)<c(CH3COO-),
故答案为:<;
(3)将HCl和CH3COONa溶液等浓度、等体积混合,反应后的溶液为醋酸和氯化钠溶液,溶液显示酸性,溶液中氢离子来自醋酸电离的和水电离的,所以氢离子浓度大于醋酸根离子浓度,溶液中离子浓度大小关系为:c(Cl-)=c(Na+)>c(H+)>c(CH3COO-)>c(OH-),
故答案为:c(Cl-)=c(Na+)>c(H+)>c(CH3COO-)>c(OH-);
(4)设稀释前NaOH 和 CH3COOH溶液的pH分别用pH3和pH4表示,将NaOH溶液稀释10倍,pH1为pH3-1,CH3COOH为弱酸,稀释醋酸的电离程度增大,CH3COOH的溶液稀释10倍,pH2<pH4+1,pH3+pH4=14,则pH1+pH2<pH3+1+pH4-1<14,
故答案为:<.
| 1 |
| 100 |
故答案为:D;
(2)pH=3的醋酸,其浓度大于0.001mol/L,pH=11的氢氧化钠,其浓度等于0.001mol/L,等体积混合后,醋酸过量,为醋酸和醋酸钠的混合溶液,则溶液显酸性,根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),c(H+)>c(OH-),则c(Na+)<c(CH3COO-),
故答案为:<;
(3)将HCl和CH3COONa溶液等浓度、等体积混合,反应后的溶液为醋酸和氯化钠溶液,溶液显示酸性,溶液中氢离子来自醋酸电离的和水电离的,所以氢离子浓度大于醋酸根离子浓度,溶液中离子浓度大小关系为:c(Cl-)=c(Na+)>c(H+)>c(CH3COO-)>c(OH-),
故答案为:c(Cl-)=c(Na+)>c(H+)>c(CH3COO-)>c(OH-);
(4)设稀释前NaOH 和 CH3COOH溶液的pH分别用pH3和pH4表示,将NaOH溶液稀释10倍,pH1为pH3-1,CH3COOH为弱酸,稀释醋酸的电离程度增大,CH3COOH的溶液稀释10倍,pH2<pH4+1,pH3+pH4=14,则pH1+pH2<pH3+1+pH4-1<14,
故答案为:<.
点评:本题考查了pH的简单计算、酸碱混合溶液酸碱性判断及离子浓度大小比较,题目难度中等,注意明确弱电解质只能部分电离,在溶液中存在电离平衡;掌握溶液pH的计算方法,学会电荷守恒在比较离子浓度大小时的应用方法.

练习册系列答案
相关题目
在强碱性溶液中,下列离子组能大量共存的是( )
| A、Al3+、Na+、SO42-、Cl- |
| B、Na+、Cu2+、SO42-、NO3- |
| C、Na+、Ba2+、NO3-、Cl- |
| D、Ba2+、HCO3-、NO3-、K+ |
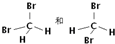 ;⑦葡萄糖和果糖; ⑧金刚石与石墨.
;⑦葡萄糖和果糖; ⑧金刚石与石墨.

 为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答:
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答: