题目内容
4.已知:6.4克铜与适量的浓硝酸反应,当铜完全溶解后,共收集到NO和NO2混合气体共2.24升(已折算为标准状况).求:(1)被还原的HNO3的物质的量0.1mol;
(2)混合气体中NO1.12 L,NO21.12 L.
分析 (1)6.4克铜与适量的浓硝酸反应,当铜完全溶解后,产物是硝酸铜和一氧化氮、二氧化氮,根据原子守恒,还原的HNO3的物质的量就等于生成的NO和NO2的物质的量的和;
(2)根据电子转移守恒与混合气体总体积列方程计算各自物质的量,相同条件下气体体积之比等于其物质的量之比.
解答 解:(1)因HNO3中+5价的N被还原成NO中的+2价和NO2中的+4价,说明HNO3中的N得到了电子,Cu是被氧化的,失去了电子,这个过程中,得失电子守恒,即HNO3中N得到的电子=Cu失去的电子,产生的还原产物NO和NO2总共2.24L(标况),所以产生的NO和NO2总的物质的量是2.24/22.4=0.1mol,无论HNO3和Cu反应生成NO也好,NO2也好,总之,发生氧化还原反应的N元素是守恒的,HNO3→NO,HNO3→NO2,是一一对应的(只看N元素守恒),还原的HNO3的物质的量,就等于生成的NO和NO2的物质的量的和为0.1mol,故答案为:0.1mol;
(2)6.4gCu的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,则转移电子为0.1mol×2=0.2mol,生成混合气体总物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
设NO2、NO的物质的量分别为xmol、ymol,则:x+y=0.1,x+3y=0.2,解得x=0.05,y=0.05,故NO2、NO的体积分别是:0.05mol×22.4L/mol=1.12L.
故答案为:1.12;1.12.
点评 本题考查混合物计算、氧化还原反应计算,侧重考查学生分析计算能力与解题方法技巧,注意理解掌握原子守恒与电子转移守恒在化学计算中应用.

练习册系列答案
 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
9.某兴趣小组为探究温度、压强对可逆反应A(g)+B(g)?C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1].然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3].
请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是( )
| A | B | C | |
| 浓度1 | 0.05mol•L-1 | a mol•L-1 | 0.05mol•L-1 |
| 浓度2 | 0.078mol•L-1 | 0.078mol•L-1 | 0.022mol•L-1 |
| 浓度3 | 0.06mol•L-1 | 0.06mol•L-1 | 0.04mol•L-1 |
| 浓度4 | 0.07mol•L-1 | 0.07mol•L-1 | 0.098mol•L-1 |
| A. | 由[浓度3]与[浓度1]的比较,可判断平衡移动的原因是增大了体系的压强 | |
| B. | 由[浓度2]与[浓度1]的比较,可判断正反应是放热反应 | |
| C. | [浓度1]中a=0.05 | |
| D. | 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
16.分子式为C5H12的化合物,共有几种不同的结构( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
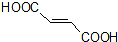 的合成路线如下:
的合成路线如下: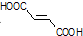
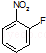 中含有的官能团名称为硝基,氟原子.
中含有的官能团名称为硝基,氟原子. .
.