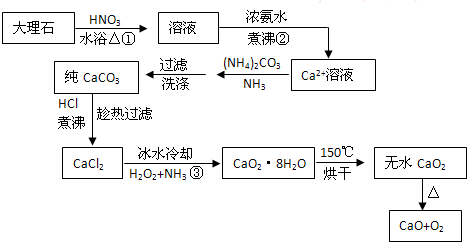
题目内容
短周期元素W、X、Y、Z的原子序数依次增大,下列相关比较错误的是( )
| A、稳定性:H2X<H2Z |
| B、酸性:H2YO3<HZO4 |
| C、还原性:W-<Z2- |
| D、半径:Y3+<Z2- |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、X、Z的最低负价均为-2,可以推断X、Z属于同一主族,由于非金属性X大于Z,故气态氢化物的稳定性H2X>H2;
B、Y的原子序数小于Z,Y可以为S,Z为Cl,据此分析即可;
C、W能形成-1价,为第ⅤⅡA族元素,Z难呢过形成-2,为ⅥA族元素,且W原子序数小于Z,故W在Z的上一周期,故非金属性W>Z,据此判断;
D、Y、Z的原子序数依次增大,Y失去3个电子,电子层数变少,Z得到两个电子,故电子层数不变,据此判断半径大小.
B、Y的原子序数小于Z,Y可以为S,Z为Cl,据此分析即可;
C、W能形成-1价,为第ⅤⅡA族元素,Z难呢过形成-2,为ⅥA族元素,且W原子序数小于Z,故W在Z的上一周期,故非金属性W>Z,据此判断;
D、Y、Z的原子序数依次增大,Y失去3个电子,电子层数变少,Z得到两个电子,故电子层数不变,据此判断半径大小.
解答:
A、X、Z的最低负价均为-2,可以推断X、Z属于同一主族,由于非金属性X大于Z,故气态氢化物的稳定性H2X>H2Z,故A错误;
B、Y的原子序数小于Z,Y可以为S,Z为Cl,酸性H2SO3<HClO4,故B正确;
C、W能形成-1价,为第ⅤⅡA族元素,Z能形成-2,为ⅥA族元素,且W原子序数小于Z,故W在Z的上一周期,故非金属性W>Z,故简单离子的还原性为:W-<Z2-,故C正确;
D、Y、Z的原子序数依次增大,Y失去3个电子,电子层数变少,Z得到2个电子,故电子层数不变,故离子半径:Y3+<Z2-,故D正确,故选A.
B、Y的原子序数小于Z,Y可以为S,Z为Cl,酸性H2SO3<HClO4,故B正确;
C、W能形成-1价,为第ⅤⅡA族元素,Z能形成-2,为ⅥA族元素,且W原子序数小于Z,故W在Z的上一周期,故非金属性W>Z,故简单离子的还原性为:W-<Z2-,故C正确;
D、Y、Z的原子序数依次增大,Y失去3个电子,电子层数变少,Z得到2个电子,故电子层数不变,故离子半径:Y3+<Z2-,故D正确,故选A.
点评:本题主要考查的是元素周期律的应用,熟练掌握有关元素周期律的知识是解决本题的关键.

练习册系列答案
相关题目
 一定温度压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )
一定温度压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )| A、气球B中装的是O2 |
| B、气球A和气球C中气体分子数相等 |
| C、气球A和气球D中气体物质的量之比为4:1 |
| D、气球C和气球D中气体密度之比为2:1 |
在溶液中能大量共存,加入OH-有沉淀析出,加入H+有气体放出的是( )
| A、Na+、Cu2+、Cl-、SO42- |
| B、Fe3+、K+、SO42-、NO3- |
| C、Zn2+、Mg2+、HSO3-、SO42- |
| D、Na+、Ca2+、Cl-、HCO3- |
下列叙述错误的是( )
| A、酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素 |
| B、只含有一种元素的物质不一定都是纯净物 |
| C、电离产生H+的化合物叫酸,其分子中氢原子的个数即是该酸的元数 |
| D、压强恒定时,气体在水中的溶解度随温度的升高而降低 |
已知:C(s)+CO2(g)?2CO(g)△H>0.该反应达到平衡后,下列条件有利于反应向正方向进行的是( )
| A、升高温度 | B、增加碳的质量 |
| C、增大压强 | D、加入催化剂 |