题目内容
根据图A、B、C、D回答下列问题: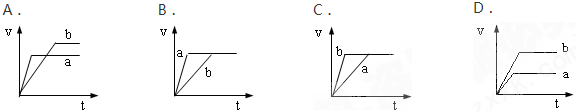
(1)将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是 .
(2)将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是 .
(3)将(1)中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图象是 .

(1)将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是
(2)将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是
(3)将(1)中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图象是
考点:化学反应速率的影响因素,化学方程式的有关计算
专题:
分析:(1)等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,发生:Fe+Cu2+=Fe2++Cu,形成原电池,反应速率增大,但生成的氢气少;
(2)反应均发生Zn+2H+═Zn2++H2↑,Zn过量,则相同体积、相同物质的量浓度的稀硫酸完全反应,生成氢气相同,且a中加入少量硫酸铜溶液,构成Cu、Zn原电池,加快反应的速率,以此来解答;
(3)向a中放入少量的醋酸钠溶液,则醋酸钠和硫酸反应生成醋酸和硫酸钠,酸性减弱,但是氢离子的物质的量不变.
(2)反应均发生Zn+2H+═Zn2++H2↑,Zn过量,则相同体积、相同物质的量浓度的稀硫酸完全反应,生成氢气相同,且a中加入少量硫酸铜溶液,构成Cu、Zn原电池,加快反应的速率,以此来解答;
(3)向a中放入少量的醋酸钠溶液,则醋酸钠和硫酸反应生成醋酸和硫酸钠,酸性减弱,但是氢离子的物质的量不变.
解答:
解:(1)等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,发生的反应为:Zn+Cu2+=Zn2++Cu,铜-铁-稀硫酸形成原电池,反应速率增大,反应用时少于b,但生成的氢气少也少于b,图象应为A.
故答案为:A.
(2)由题意可知,反应均发生Zn+2H+═Zn2++H2↑,Zn过量,则相同体积、相同物质的量浓度的稀硫酸完全反应,生成氢气相同,
且a中加入少量硫酸铜溶液,构成Cu、Zn原电池,加快反应的速率,所以a反应速率快,达到反应结束时的时间短,显然只有B图象符合,
故答案为:B.
(3)等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的醋酸钠溶液,则醋酸钠和硫酸反应生成醋酸和硫酸钠,酸性减弱,所以速率减慢,但是氢离子的物质的量不变,所以反应产生氢气的量不变,故答案为:C.
故答案为:A.
(2)由题意可知,反应均发生Zn+2H+═Zn2++H2↑,Zn过量,则相同体积、相同物质的量浓度的稀硫酸完全反应,生成氢气相同,
且a中加入少量硫酸铜溶液,构成Cu、Zn原电池,加快反应的速率,所以a反应速率快,达到反应结束时的时间短,显然只有B图象符合,
故答案为:B.
(3)等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的醋酸钠溶液,则醋酸钠和硫酸反应生成醋酸和硫酸钠,酸性减弱,所以速率减慢,但是氢离子的物质的量不变,所以反应产生氢气的量不变,故答案为:C.
点评:本题考查了根据图象判断反应速率的大小,难度不大,分析图象时注意图象的拐点及走向和变化趋势.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
加入适当的氧化剂才能实现下列变化的是( )
| A、Fe2+→Fe3+ |
| B、S2-→H2S |
| C、MnO4-→Mn2+ |
| D、AlO2-→Al3+ |
 一定温度压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )
一定温度压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )| A、气球B中装的是O2 |
| B、气球A和气球C中气体分子数相等 |
| C、气球A和气球D中气体物质的量之比为4:1 |
| D、气球C和气球D中气体密度之比为2:1 |
下列叙述错误的是( )
| A、酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素 |
| B、只含有一种元素的物质不一定都是纯净物 |
| C、电离产生H+的化合物叫酸,其分子中氢原子的个数即是该酸的元数 |
| D、压强恒定时,气体在水中的溶解度随温度的升高而降低 |
下列说法正确的是( )
| A、泥沙和水的混合物可用分液漏斗分离 |
| B、测溶液pH值:将一小块pH试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照 |
| C、用丁达尔现象可区分氢氧化铁胶体和氯化铁溶液 |
| D、氢氧化钠溶液保存在带有玻璃塞的试剂瓶中 |
 根据图中信息,请写出:
根据图中信息,请写出: