题目内容
4.a、b、c、d为原子序数依次增大的四种短周期主族元素,其原子核外L电子层的电子数分别为0、5、6、8,它们的最外层电子数之和为17,下列说法不正确的是( )| A. | 原子半径:b<c | |
| B. | 最高价氧化物对应水化物的酸性:b>d | |
| C. | 单质沸点:d>c | |
| D. | a、b、c不能存在于同一离子化合物中 |
分析 a、b、c、d为原子序数依次增大的四种短周期主族元素,且原子核外L电子层的电子数分别为0、5、6、8,则a没有L层电子,则a是H元素;b的L层电子为5,则b含有7个电子,b是N元素;c的L层电子为6,则c含有8个电子,c是O元素;它们的最外层电子数之和为17,a最外层电子数是1,b最外层电子数是5,c最外层电子数是6,则d的最外层电子数为5,则d是P元素,结合元素化合物的性质及元素周期律解答.
解答 解:a、b、c、d为原子序数依次增大的四种短周期主族元素,且原子核外L电子层的电子数分别为0、5、6、8,则a没有L层电子,则a是H元素;b的L层电子为5,则b含有7个电子,b是N元素;c的L层电子为6,则c含有8个电子,c是O元素;它们的最外层电子数之和为17,a最外层电子数是1,b最外层电子数是5,c最外层电子数是6,则d的最外层电子数为5,则d是P元素,
A.电子层越多半径越大,电子层相同时,原子序数越大,半径越小,则原子半径:N>O,即b>c,故A错误;
B.同主族从上到下最高价氧化物对应水化物的酸性减弱,则硝酸的酸性大于磷酸,即最高价氧化物对应水化物的酸性:b>d,故B正确;
C.常温下,P的单质为固体,O的单质为气体,则单质沸点d>c,故C正确;
D.H、N、O可以形成硝酸铵,所以a、b、c能存在于同一离子化合物中,故D错误.
故选AD.
点评 本题考查原子结构和元素性质,涉及离子化合物判断、酸性强弱判断、物质熔沸点高低判断、元素周期律等知识点,正确判断元素是解本题关键,结合物质的结构性质解答.

练习册系列答案
相关题目
14.下列关于元素周期表和周期律说法中,正确的是( )
| A. | 周期表中,元素所在的族序数等于原子的最外层电子数 | |
| B. | 同主族元素,随原子序数的增大,原子半径增大,主要原因是核电荷数增大 | |
| C. | 第二周期元素随原子序数的递增,元素原子的第一电离能依次递增 | |
| D. | 第 VIIA族元素从上到下,元素电负性逐渐减小 |
12.下列说法不正确的是( )
| A. | 定容时,因不慎使液面高于容量的刻度线,需重新配制 | |
| B. | 焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后进行实验 | |
| C. | 将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色 | |
| D. | 取少量晶体放入试管中,加入适量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明该晶体中含有NH4+ |
9.某同学用下列装置制备并检验Cl2的性质.下列说法错误的是( )
| A. | 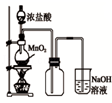 如图中:MnO2过量,盐酸能全部消耗 | B. | 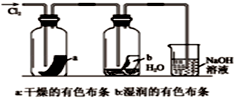 如图中:湿润的有色布条能褪色 | ||
| C. | 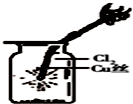 如图中:生成棕色的烟 | D. | 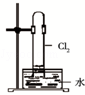 如图中:水可以充满试管 |