题目内容
1.下列各项关系互为同位素的是( )| A. | 石墨和金刚石 | B. | 水和重水 | C. | 甲烷和丁烷 | D. | 氕和氚 |
分析 具有相同质子数,不同中子数的原子互为同位素,以此来解答.
解答 解:A.石墨和金刚石为碳元素的不同单质,互为同素异形体,故A不选;
B.水和重水为化合物,均为水,故B不选;
C.甲烷和丁烷均属于饱和烷烃,结构相似,分子组成上相差2个CH2原子团,故互为同分异构体,故C不选;
D.氕和氚的质子数均为1,中子数分别为0、2,均为H原子,则互为同位素,故D选;
故选D.
点评 本题考查同位素,注意同位素的分析对象为原子,侧重“五同”概念的辨析与判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.某化学小组用下图所列装置(固定装置略)验证CO能还原CuO,并探究其还原产物的组成.
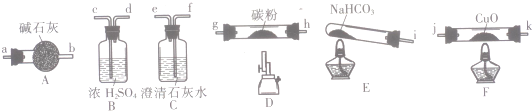
请回答:
(1)按气流方向,各装置从左到右的连接顺序为icd;gh(或hg);ab;jk(或kj);fe尾气处理(填仪器接口的字母编号);
(2)说明CO能还原CuO的实验现象为F处硬质玻璃管中的黑色固体变为红色,C处澄清石灰水变浑浊;
(3)该实验处理尾气的方法为点燃烧掉或用气囊收集;
(4)若去掉B装置,可能产生的影响为NaHCO3分解产生的水蒸气高温能与碳粉反应生成H2,对实验产生干扰;
(5)将各装置按正确的顺序连接后进行实验.当反应结束后,F处硬质玻璃管中的固体全部变为红色.
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+.
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③Cu和Cu2O;
[实验验证]该小组为验证上述猜想,分别取少量红色固体放人试管中,进行如下实验.
[实验评价]根据上述实验,不能确定红色固体成分的实验是a(填实验编号),理由为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O.(用化学方程式表示);
[实验结论]根据上述实验结果,可知红色固体的成分为Cu(填化学式).

请回答:
(1)按气流方向,各装置从左到右的连接顺序为icd;gh(或hg);ab;jk(或kj);fe尾气处理(填仪器接口的字母编号);
(2)说明CO能还原CuO的实验现象为F处硬质玻璃管中的黑色固体变为红色,C处澄清石灰水变浑浊;
(3)该实验处理尾气的方法为点燃烧掉或用气囊收集;
(4)若去掉B装置,可能产生的影响为NaHCO3分解产生的水蒸气高温能与碳粉反应生成H2,对实验产生干扰;
(5)将各装置按正确的顺序连接后进行实验.当反应结束后,F处硬质玻璃管中的固体全部变为红色.
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+.
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③Cu和Cu2O;
[实验验证]该小组为验证上述猜想,分别取少量红色固体放人试管中,进行如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量稀硝酸、振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
| b | 加入足量稀硫酸、振荡 | 试管内有红色固体,溶液为无色 |
3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O.(用化学方程式表示);
[实验结论]根据上述实验结果,可知红色固体的成分为Cu(填化学式).
12.下列各组顺序的排列正确的是( )
| A. | 最高正化合价:F>O>N>C>Al | B. | 离子半径:F->O2->Na+>Al3+ | ||
| C. | 热稳定性:PH3<H2S<HCl<HF | D. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3>KOH |
9.下列离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 过氧化钠反应生成NaOH和H2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
16.下列各组物质及粒子性质变化不正确的是( )
| A. | 酸性:H2SO4>H3AsO4>H3PO4 | |
| B. | 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3 | |
| C. | 金属单质置换出氢的能力:Cs>Rb>K>Ca | |
| D. | 氧化性:F2>Cl2>S |
6.下列关于H2在O2中燃烧生成液态水过程描述正确的是( )
| A. | 该反应过程的热效应称为燃烧热 | |
| B. | 该过程是吸热反应 | |
| C. | 生成物的总能量等于反应物的总能量 | |
| D. | 化学能转变成热能 |
13.X2+的核外电子数分别为2、8、8,则X元素在周期表中的位置是( )
| A. | 第三周期零族 | B. | 第四周期第IIA族 | C. | 第三周期第ⅠA族 | D. | 第三周期第ⅦA族 |
10.下列关于元素周期表的说法中正确的是( )
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 同周期相邻主族元素的原子,其质子数之差均为1 | |
| C. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| D. | 从左到右,元素周期表中的第5列为VA族 |
11.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 7.8 g Na2O2与足量水反应转移的电子数为0.1NA | |
| B. | 常温常压下,22.4LCH4中含有的氢原子数为4NA | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.2NA | |
| D. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- |