题目内容
2.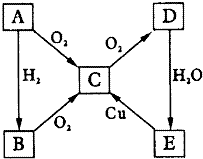 如图所示转化关系,A为单质,试对下列情况进行推断,并回答下列问题:
如图所示转化关系,A为单质,试对下列情况进行推断,并回答下列问题:(1)A为固体时:
①A的化学式为S,
②写出由C生成D的化学方程式2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,
③写出由E生成C的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)A为气体时:
①A的化学式为N2,
②写出由B生成C的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
③写出由D生成E的离子方程式3NO2+H2O═2H++2NO3-+NO,
④写出由E生成C的离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
分析 A为单质,由转化关系可知,B为氢化物,C为氧化物,D为氧化物,E为酸,中学中N、S元素单质化合物符合转化关系.
(1)A为固体,则A为S,B为H2S,C为SO2,D为SO3,E为H2SO4;
(2)A为气体,则A为N2,B为NH3,C为NO,D为NO2,E为HNO3.
解答 解:A为单质,由转化关系可知,B为氢化物,C为氧化物,D为氧化物,E为酸,中学中N、S元素单质化合物符合转化关系.
(1)A为固体,则A为S,B为H2S,C为SO2,D为SO3,E为H2SO4,
①A的化学式为S,故答案为:S;
②由C生成D的化学方程式:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,故答案为:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
③由E生成C的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)A为气体,则A为N2,B为NH3,C为NO,D为NO2,E为HNO3.
①A的化学式为:N2,故答案为:N2;
②由B生成C的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
③由D生成E的离子方程式:3NO2+H2O═2H++2NO3-+NO,故答案为:3NO2+H2O═2H++2NO3-+NO;
④由E生成C的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评 本题考查无机物的推断,涉及N、S元素单质化合物性质,注意识记中学常见的连续氧化反应,熟练掌握元素化合物性质,比较基础.

 阅读快车系列答案
阅读快车系列答案| A. | 二氧化硅可用于制造光导纤维 | |
| B. | 石英玻璃可用于制造光学仪器 | |
| C. | 玻璃在加热融化时有固定的熔点 | |
| D. | 制普通玻璃的原料是纯碱、石灰石、石英 |
| A. | Li、Na、K元素的金属性依次减弱 | |
| B. | P、S、Cl元素的最高正价依次降低 | |
| C. | Li、Be、B的原子最外层电子数依次减少 | |
| D. | Na+、Mg2+、Al3+的离子半径依次减少 |
| A. | H2(g)+Br2(g)?2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变 | |
| B. | 2NO2(g)?N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变 | |
| C. | CaCO3(s)?CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的密度保持不变 | |
| D. | 3H2(g)+N2(g)?2NH3(g) 反应体系中H2与N2的物质的量之比保持3:1 |
| A. | 汽车尾气中的CO﹑NO等都是大气污染物 | |
| B. | 氢键﹑离子键﹑共价键都是微粒间的作用力,且属于化学键 | |
| C. | 高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
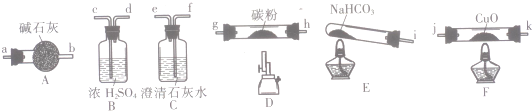
请回答:
(1)按气流方向,各装置从左到右的连接顺序为icd;gh(或hg);ab;jk(或kj);fe尾气处理(填仪器接口的字母编号);
(2)说明CO能还原CuO的实验现象为F处硬质玻璃管中的黑色固体变为红色,C处澄清石灰水变浑浊;
(3)该实验处理尾气的方法为点燃烧掉或用气囊收集;
(4)若去掉B装置,可能产生的影响为NaHCO3分解产生的水蒸气高温能与碳粉反应生成H2,对实验产生干扰;
(5)将各装置按正确的顺序连接后进行实验.当反应结束后,F处硬质玻璃管中的固体全部变为红色.
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+.
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③Cu和Cu2O;
[实验验证]该小组为验证上述猜想,分别取少量红色固体放人试管中,进行如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量稀硝酸、振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
| b | 加入足量稀硫酸、振荡 | 试管内有红色固体,溶液为无色 |
3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O.(用化学方程式表示);
[实验结论]根据上述实验结果,可知红色固体的成分为Cu(填化学式).
| A. | 最高正化合价:F>O>N>C>Al | B. | 离子半径:F->O2->Na+>Al3+ | ||
| C. | 热稳定性:PH3<H2S<HCl<HF | D. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3>KOH |
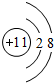 ;YW2的电子式
;YW2的电子式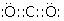 .
.