题目内容
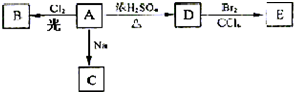
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A 、B 、乙
(2)写出反应①的化学方程式:
(3)写出反应⑥的离子方程式:
(4)实验室里乙的尾气常常用 溶液吸收.

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A
(2)写出反应①的化学方程式:
(3)写出反应⑥的离子方程式:
(4)实验室里乙的尾气常常用
考点:无机物的推断
专题:
分析:金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,考虑Na与水的反应,故甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)→F→G可知,C为Fe,F为FeCl2,G为FeCl3,据此答题;
解答:
解:金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,考虑Na与水的反应,故甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)→F→G可知,C为Fe,F为FeCl2,G为FeCl3,
(1)由上述分析可知,A为Na,B为Al,乙为Cl2,
故答案为:Na;Al;Cl2;
(2)反应①的化学方程式为2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
(3)反应⑥的离子方程式为Fe3++3OH-═Fe(OH)3↓,
故答案为:Fe3++3OH-═Fe(OH)3↓;
(4)实验室里氯气的尾气常常用氢氧化钠溶液吸收,
故答案为:NaOH;
(1)由上述分析可知,A为Na,B为Al,乙为Cl2,
故答案为:Na;Al;Cl2;
(2)反应①的化学方程式为2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
(3)反应⑥的离子方程式为Fe3++3OH-═Fe(OH)3↓,
故答案为:Fe3++3OH-═Fe(OH)3↓;
(4)实验室里氯气的尾气常常用氢氧化钠溶液吸收,
故答案为:NaOH;
点评:本题以无机框图题的形式考查Na、Al、Fe、Cl等元素单质及其化合物之间的相互转化关系、化学用语的书写、尾气的吸收等,难度中等,注意基础知识的掌握.

练习册系列答案
相关题目
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、58.5g氯化钠中约含有6.02×1023个氯化钠分子 |
| B、含有2NA个阴离子的CaC2,在标准状况下,能产生约44.8L的乙炔气体 |
| C、在含4mol Si-O键的石英晶体中,氧原子的数目为4NA |
| D、12.5mL 16mol?L-1浓硫酸与足量锌反应,转移电子数为0.2NA |
将8.7g MnO2粉末与含14.6gHCl的浓盐酸共热,完全反应后,生成的氯气体积(标准状况)( )
| A、等于4.48L |
| B、等于2.24L |
| C、介于2.24~4.48L |
| D、小于2.24L |


 某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol?L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液.发生的反应为:
某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol?L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液.发生的反应为: