题目内容
设NA为阿佛加德罗常数,下列说法正确的是( )
①32g O2和O3混合气体中含有原子数为2NA
②1molFe被完全氧化生成Fe2O3,失去个3NA电子
③1L 2mol/L的氯化镁溶液中含氯离子为4NA
④标准状况下22.4LH2O中分子数为NA
⑤78gNa2O2含有阴、阳离子总数是4NA.
①32g O2和O3混合气体中含有原子数为2NA
②1molFe被完全氧化生成Fe2O3,失去个3NA电子
③1L 2mol/L的氯化镁溶液中含氯离子为4NA
④标准状况下22.4LH2O中分子数为NA
⑤78gNa2O2含有阴、阳离子总数是4NA.
| A、①②③ | B、③④ |
| C、①③④ | D、①②③⑤ |
考点:阿伏加德罗常数
专题:
分析:①根据O2和O3均由氧原子构成来计算;
②根据反应后铁的化合价来判断;
③根据1molMgCl2中含2molCl-来计算;
④标况下,水为液态;
⑤Na2O2由Na+和O22-构成.
②根据反应后铁的化合价来判断;
③根据1molMgCl2中含2molCl-来计算;
④标况下,水为液态;
⑤Na2O2由Na+和O22-构成.
解答:
解:①O2和O3均由氧原子构成,32gO2和O3含有的氧原子的物质的量n=
=
=2mol,故含有原子数为2NA,故①正确;
②反应后铁的化合价为+3价,故1mol铁失去3mol电子,故②正确;
③1L 2mol/L的氯化镁溶液中氯化镁的物质的量n=CV=1L×2mol/L=2mol,而1molMgCl2中含2molCl-,故2mol氯化镁含4molCl-,故③正确;
④标况下,水为液态,故④错误;
⑤78gNa2O2的物质的量为1mol,而Na2O2由Na+和O22-构成,故78gNa2O2含3mol离子,故⑤错误.
故选A.
| m |
| M |
| 32g |
| 16g/mol |
②反应后铁的化合价为+3价,故1mol铁失去3mol电子,故②正确;
③1L 2mol/L的氯化镁溶液中氯化镁的物质的量n=CV=1L×2mol/L=2mol,而1molMgCl2中含2molCl-,故2mol氯化镁含4molCl-,故③正确;
④标况下,水为液态,故④错误;
⑤78gNa2O2的物质的量为1mol,而Na2O2由Na+和O22-构成,故78gNa2O2含3mol离子,故⑤错误.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
下列有关卤素及其化合物的递变规的描述中,错误的是( )
| A、原子半径:F<Cl<Br<I |
| B、熔点:F2<Cl2<Br2<I2 |
| C、氧化性:F2>Cl2>Br2>I2 |
| D、还原性:F->Cl->Br->I- |
2013年4月22日是第44个“世界地球日”,其主题为“珍惜地球资源,转变发展方式--促进生态文明,共建美丽中国”.下列做法不符合这一主题的是( )
| A、开发太阳能、风能和氢能等能源 |
| B、大量开采地下水,以满足生产、生活的需求 |
| C、在含硫的煤中加入适量生石灰 |
| D、利用可降解的“玉米塑料”生产一次性饭盒 |
下列有关化学用语使用正确的是( )
A、醛基的电子式: |
B、CH4Si的结构式: |
C、3,3-二甲基-1-戊烯的键线式: |
D、硝基苯的结构简式: |
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、14 g氮气中含有7 NA个电子 |
| B、在0℃、101 kPa时,22.4 L CCl4中含有NA个碳原子 |
| C、2 L浓度为0.5 mol/L 硫酸溶液中含有NA个氢离子 |
| D、16 g CH4与18 g NH4+所含质子数相等,均为10 NA |
下列离子方程式正确的是( )
| A、二氧化硅与强碱溶液反应:SiO2+2OH-=SiO32-+H2O |
| B、将氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| C、金属钠与水反应:Na+H2O=Na++OH-+H2↑ |
| D、少量的金属锌加入到FeCl3溶液中:2Fe3++3Zn=2Fe+3Zn2+ |
溶液、胶体和浊液这三种分散系的根本区别是( )
| A、是否为大量分子或离子的集合体 |
| B、分散质微粒直径的大小 |
| C、是否能通过滤纸或有丁达尔现象 |
| D、是否均一、稳定、透明 |
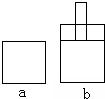 如图所示两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在起始温度、体积相等的条件下,按下列两种情况投料.
如图所示两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在起始温度、体积相等的条件下,按下列两种情况投料.Ⅰ、向a和b中充入等物质的量的NO2,发生反应:2NO2?N2O4;△H<0;
Ⅱ、向a和b中充入等物质的量的N2O4,发生反应:N2O4?2NO2;△H>0.
以下判断对Ⅰ、Ⅱ两种情况均正确的是( )
| A、反应起始时,两容器内反应速率va和vb的关系为:va=vb |
| B、反应过程中,两容器内反应速率va和vb的关系为:va<vb |
| C、反应达平衡时,两容器内反应物的转化率αa和αb的关系为:αa<αb |
| D、反应达平衡时,两容器内压强Pa和Pb的关系为:Pa>Pb |