题目内容
根据反应式:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe3+可判断离子的还原性由强到弱的顺序是( )
| A、Br-、Fe2+、I- |
| B、Br-、I-、Fe2+ |
| C、I-、Fe2+、Br- |
| D、Fe2+、I-、Br- |
考点:氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:根据元素的化合价升高来判断还原剂,利用氧化还原反应中还原剂的还原性大于还原产物的还原性来解答.
解答:
解:2Fe3++2I-=2Fe2++I2中,I元素的化合价升高,由还原剂的还原性大于还原产物的还原性,则还原性I->Fe2+,
Br2+2Fe2+=2Fe3++2Br-中,Fe元素的化合价升高,由还原剂的还原性大于还原产物的还原性,则还原性Fe2+>Br-,
所以离子的还原性由强到弱的顺序为I->Fe2+>Br-,
故选C.
Br2+2Fe2+=2Fe3++2Br-中,Fe元素的化合价升高,由还原剂的还原性大于还原产物的还原性,则还原性Fe2+>Br-,
所以离子的还原性由强到弱的顺序为I->Fe2+>Br-,
故选C.
点评:本题考查了还原性强弱的比较,难度不大,根据“同一化学反应中,氧化剂的还原性大于还原产物的还原性”来分析解答即可.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
下列叙述中正确的是( )
| A、乙醇和丙三醇互为同系物 |
| B、16gCH4和18gNH4+所含的质子数相等 |
| C、32S和33S的核外电子数相等,属于同一种核素 |
| D、质量相等,体积不等的CO和C2H4的分子数相等 |
以下对生活事实的解释,不正确的是( )
| A、厨房里洗涤油污,常用碱性洗涤剂,因为植物油会在碱性溶液中水解 |
| B、2013年1月1日起,我省正式发布环境空气质量指数(AQI),包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标 |
| C、用加酶洗衣粉在温水中不能洗涤毛料服装 |
| D、将实验室的废酸液和废碱液中和后再排放符合“绿色化学”的要求 |
有关下列四个常用电化学装置的叙述中,正确的是( )
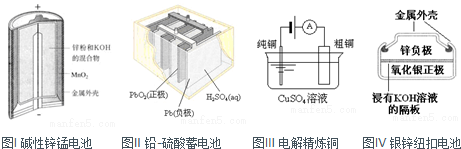

| A、图I所示电池中,的作用是催化剂 |
| B、图Ⅱ所示电池放电过程中,硫酸浓度不断增大 |
| C、图Ⅲ所示装置工作过程中,电解质溶液中浓度始终不变 |
| D、图IV所示电池中,是氧化剂,电池工作过程中还原为Ag |
下列离子方程式书写正确的是( )
| A、Fe(NO3)3加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、硫酸镁溶液与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
| C、等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、Cu溶于足量稀硝酸:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下4.6g NO2和N2O4混合气体所含原子总数为0.3NA |
| B、标准状况下,22.4L SO3的分子数为NA |
| C、1molFe在22.4L的Cl2(标准状况下)燃烧,转移的电子总数为3NA |
| D、电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠 |
固体粉末X中可能含有Fe、Fe2O3、MnO2、CuO、K2SiO3、K2SO3、NaNO2、KAlO2中的若干种.某同学为确定该固体粉末的成分,取X进行连续实验:以下说法正确的是( )
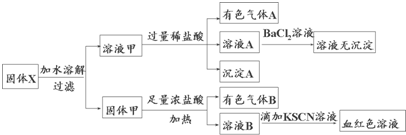

| A、溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2 |
| B、由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3 |
| C、气体A和气体B一定均为纯净物 |
| D、原混合物中一定含有Fe2O3 |
 根据图示装置,下列说法不正确的是( )
根据图示装置,下列说法不正确的是( )