题目内容
17.下列有关表述错误的是( )| A. | IBr的电子式为  | |
| B. | HClO的结构式为H-O-Cl | |
| C. | HIO各原子都满足8电子结构 | |
| D. | 共价化合物内部可能有极性键和非极性键 |
分析 A.溴和碘原子最外层都含有7个电子,IBr中形成1对共用电子对,使Br、I原子均满足8电子稳定结构;
B.次氯酸的中心原子为O原子,分子中含有1个O-H键和1个O-Cl键;
C.HIO中H原子原子最外层电子数2;
D.有的共价化合物中含有极性键和非极性键,如含有多个C的烃类分子中.
解答 解:A.I、Br最外层均有7个电子,通过共用一对电子即可达到8电子稳定结构,故A正确;
B.H、Cl、O三原子之间通过共用电子对形成次氯酸,其电子式为 ,则结构式为:H-O-Cl,故B正确;
,则结构式为:H-O-Cl,故B正确;
C.HIO的结构与HClO类似,其中I、O两原子的最外层达到8电子稳定结构,H原子最外层只有2个电子,故C错误;
D.共价化合物中可以含有有极性键和非极性键,如乙烷、丙烷、丁烯等,故D正确;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构式、化学键、核外电子排布等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
7.烷烃X分子中碳与氢质量比为36:7.现取两支试管,分别加入适量溴水,实验操作及现象如图.下列有关X的说法不正确的是( )
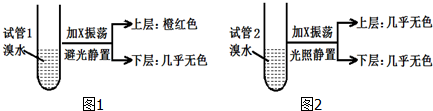

| A. | 相同条件下,X的密度比水小 | |
| B. | X的同分异构体共有5种 | |
| C. | X与溴水因发生加成反应而使溴水褪色 | |
| D. | 实验后试管2中的有机层在上层还是下层,可通过加水确定 |
8.日本核电站泄漏物中含有放射性的53131I.有关53131I的说法不正确是( )
| A. | 中子数为78 | B. | 质子数为53 | C. | 质量数为131 | D. | 核外电子数是78 |
5.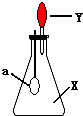 如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
 如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )| A. | X是NH3,Y是水 | B. | X是SO2,Y是KOH浓溶液 | ||
| C. | X是CO2,Y是稀盐酸 | D. | X是HCl,Y是NaCl稀溶液 |
12.下列关于化学反应的速率和限度的说法错误的是( )
| A. | 化学反应速率通过用单位时间里反应物浓度或生成物浓度的变化量表示 | |
| B. | 化学平衡状态指的是在一定条件下反应物和生成物浓度不再改变时的状态 | |
| C. | 决定化学反应速率的主要因素是温度 | |
| D. | 催化剂只能加快化学反应速率,不能提高原料利用率和转化率 |
2.下列表示不正确的是( )
| A. | 1mol H2 | B. | 1molFe | C. | 1mol小米 | D. | 1mol NH3 |
9.在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)?2Z(g),不能说明此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的百分含量不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | v正(X)=2v逆(Y) |
 .
. 、
、 、
、 (其中一种).
(其中一种).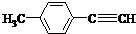 )的一条路线如下:
)的一条路线如下: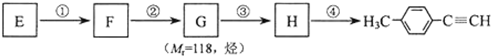
 ;
;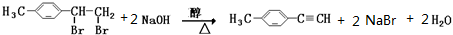 .
.