题目内容
已知A为常见的金属单质,根据如图所示的转化关系回答下列问题.

(1)确定A、B、C、D、E、F的化学式:
A为 ,B为 ,C为 .
D为 ,E为 ,F为 .
(2)写出⑧的化学方程式及④、⑤的离子方程式: .

(1)确定A、B、C、D、E、F的化学式:
A为
D为
(2)写出⑧的化学方程式及④、⑤的离子方程式:
考点:无机物的推断
专题:
分析:由转化关系图可知,红褐色固体F为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,D为FeCl3,A为Fe,B为Fe3O4,然后结合物质的性质及化学用语来解答.
解答:
解:由转化关系图可知,红褐色固体F为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,D为FeCl3,A为Fe,B为Fe3O4,
(1)由上分析知A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,故答案为:Fe;Fe3O4;FeCl2;FeCl3;Fe(OH)2;Fe(OH)3;
(2)反应⑧为4Fe(OH)2的氧化,方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,④的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,⑤的离子方程式为2Fe3++Fe=3Fe2+,故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3、2Fe2++Cl2═2Fe3++2Cl-、2Fe3++Fe=3Fe2+.
(1)由上分析知A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,故答案为:Fe;Fe3O4;FeCl2;FeCl3;Fe(OH)2;Fe(OH)3;
(2)反应⑧为4Fe(OH)2的氧化,方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,④的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,⑤的离子方程式为2Fe3++Fe=3Fe2+,故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3、2Fe2++Cl2═2Fe3++2Cl-、2Fe3++Fe=3Fe2+.
点评:本题考查无机物的推断,注意物质的颜色为解答本题的突破口,熟悉铁及其化合物的性质即可解答,注意氧化还原反应,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
铝用作焊接钢轨是利用( )
| A、铝同氧气反应生成稳定的保护层 |
| B、铝是热的良导体 |
| C、铝合金强度大 |
| D、铝是强还原剂,铝热反应放热 |
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z原子的最外层电子数是其内层电子数的3倍.下列说法正确的是( )
| A、元素Z、W的简单离子的电子层结构不同 |
| B、元素的非金属性由强到弱:Y>Z>X |
| C、只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
| D、元素Y的气态氢化物与其最高价氧化物对应的水化物不反应 |
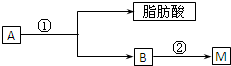
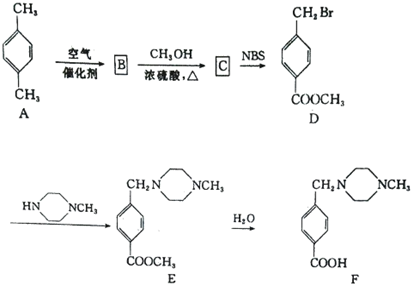
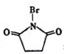 ,则反应C→D的化学方程式为
,则反应C→D的化学方程式为
 请回答下列问题:
请回答下列问题: