题目内容
标准状况下,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,充入时体积如图所示,若将装置右边H2、O2的混合气体点燃引爆,活塞先左弹,恢复至原温度后,活塞右滑最终停在容器的正中央,则原来H2、O2的体积比最接近于( )
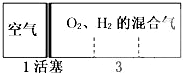
①2:7 ②5:4 ③4:5 ④7:2.
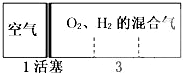
①2:7 ②5:4 ③4:5 ④7:2.
| A、①② | B、②④ | C、③④ | D、①③ |
考点:有关混合物反应的计算
专题:
分析:反应前,左右两室的体积之比为1:3,则左右两室中气体物质的量之比为1:3,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,令空气的物质的量为1mol,设H2、O2的物质的量分别为xmol、ymol,讨论氢气或氧气过量计算解答.
解答:
解:令空气的物质的量为1mol,反应前,左右两室的体积之比为1:3,反应前右室的物质的量为3mol,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,反应后右室气体物质的量为1mol,发生反应2H2+O2
2H2O,
设H2、O2的物质的量分别为xmol、ymol,
若氢气过量,则:x-2yy=1,x+y=3,解得x:y=7:2,
若氧气过量,则:yy-0.5x=1,x+y=3,解得x:y=4:5,
故选C.
| ||
设H2、O2的物质的量分别为xmol、ymol,
若氢气过量,则:x-2yy=1,x+y=3,解得x:y=7:2,
若氧气过量,则:yy-0.5x=1,x+y=3,解得x:y=4:5,
故选C.
点评:本题考查混合物计算,注意左室中气体物质的量不变,据此根据体积变化判断右室反应前后气体物质的量,再利用赋值法与讨论法计算,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列解释事实或实验现象的离子方程式不正确的是( )
| A、用食醋除去暖水瓶中的水垢,水垢溶解,有无色气泡产生:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| B、用稀硫酸除去铜绿:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O |
| C、向NaHCO3和CaCl2混合溶液中,加入少量NaOH溶液:OH-+HCO32-═CO32-+H2O |
| D、用小苏打治疗胃酸过多:HCO3-+H+═H2O+CO2↑ |
已知A为常见的金属单质,根据如图所示的转化关系回答下列问题.

(1)确定A、B、C、D、E、F的化学式:
A为 ,B为 ,C为 .
D为 ,E为 ,F为 .
(2)写出⑧的化学方程式及④、⑤的离子方程式: .

(1)确定A、B、C、D、E、F的化学式:
A为
D为
(2)写出⑧的化学方程式及④、⑤的离子方程式:
常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,下列判断一定正确的是( )
| A、若c(OH-)>c(H+),a=b |
| B、若c(K+)>c(CH3COO-),a>b |
| C、若c(OH-)=c(H+),a>b |
| D、若c(K+)<c(CH3COO-),a<b |
根据原子结构及元素周期律的知识,下列推断正确的是( )
A、
| ||||
| B、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
| D、核外电子排布相同的微粒化学性质也相同 |
下列说法正确的是( )
| A、碳酸氢钠的热稳定性小于碳酸钠的 |
| B、Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
| C、可用石灰水区分Na2CO3与NaHCO3溶液 |
| D、滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存 |
下列说法正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、吸热反应在不加热的条件下一定不能发生 |
| C、吸热反应的反应物的总能量之和小于生成物的总能量之和 |
| D、某可逆反应,若正反应为吸热反应,逆反应也可能是吸热反应 |
